第99页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
4. (2025·亳州市一模)实验室常用下列装置来制取氧气。
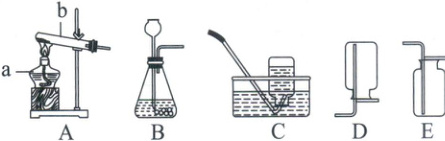
(1)写出图中有标号仪器的名称:b
(2)用B装置制取氧气时,长颈漏斗下端管口在液面以下的原因:
(3)高锰酸钾制取氧气的化学方程式为
(4)用C装置收集氧气的优点是

(1)写出图中有标号仪器的名称:b
试管
。(2)用B装置制取氧气时,长颈漏斗下端管口在液面以下的原因:
防止生成的气体从长颈漏斗中逸出
,其装置的不足之处是:不能控制反应的发生和停止,也不能控制反应速率(合理即可)
。(3)高锰酸钾制取氧气的化学方程式为
$\mathrm{2KMnO_4 \xlongequal{\triangle} K_2MnO_4 + MnO_2 + O_2 \uparrow}$
。(4)用C装置收集氧气的优点是
收集到的氧气比较纯净
。
答案:
(1)试管
(2)防止生成的气体从长颈漏斗中逸出 不能控制反应的发生和停止,也不能控制反应速率(合理即可)
(3)$\mathrm{2KMnO_4 \xlongequal{\triangle} K_2MnO_4 + MnO_2 + O_2 \uparrow}$
(4)收集到的氧气比较纯净
[解析]
(1)根据图像,仪器b是试管。
(2)如果长颈漏斗下端管口在液面以上,生成的气体会从长颈漏斗逸出,所以要液封防止气体逸出;B装置中,一旦将液体药品加入,反应就持续进行,不能控制反应的发生和停止,也不能控制反应速率。
(3)高锰酸钾在加热条件下分解,生成锰酸钾、二氧化锰和氧气,化学方程式为$\mathrm{2KMnO_4 \xlongequal{\triangle} K_2MnO_4 + MnO_2 + O_2 \uparrow}$。
(4)C装置是排水法收集氧气,排水法收集气体时,空气不易混入,所以收集到的氧气比较纯净。
(1)试管
(2)防止生成的气体从长颈漏斗中逸出 不能控制反应的发生和停止,也不能控制反应速率(合理即可)
(3)$\mathrm{2KMnO_4 \xlongequal{\triangle} K_2MnO_4 + MnO_2 + O_2 \uparrow}$
(4)收集到的氧气比较纯净
[解析]
(1)根据图像,仪器b是试管。
(2)如果长颈漏斗下端管口在液面以上,生成的气体会从长颈漏斗逸出,所以要液封防止气体逸出;B装置中,一旦将液体药品加入,反应就持续进行,不能控制反应的发生和停止,也不能控制反应速率。
(3)高锰酸钾在加热条件下分解,生成锰酸钾、二氧化锰和氧气,化学方程式为$\mathrm{2KMnO_4 \xlongequal{\triangle} K_2MnO_4 + MnO_2 + O_2 \uparrow}$。
(4)C装置是排水法收集氧气,排水法收集气体时,空气不易混入,所以收集到的氧气比较纯净。
1. (2025·吉林)下图是实验室制取气体的部分装置,回答下列问题。
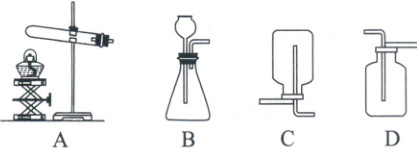
(1)实验室用大理石和稀盐酸制取二氧化碳,发生反应的化学方程式为
(2)用上述装置制取二氧化碳时,选择发生装置和收集装置的组合是
(3)证明二氧化碳是否集满的方法是

(1)实验室用大理石和稀盐酸制取二氧化碳,发生反应的化学方程式为
$\mathrm{CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow}$
。(2)用上述装置制取二氧化碳时,选择发生装置和收集装置的组合是
BD
。(3)证明二氧化碳是否集满的方法是
将燃着的木条放在集气瓶口,若木条熄灭,说明已集满
。
答案:
(1)$\mathrm{CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow}$
(2)BD
(3)将燃着的木条放在集气瓶口,若木条熄灭,说明已集满
(1)$\mathrm{CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow}$
(2)BD
(3)将燃着的木条放在集气瓶口,若木条熄灭,说明已集满
2. (2025·苏州)某同学在实验室制取CO₂并进行研究。

(1)该同学拟用块状石灰石制CO₂。
①应选用的另一种试剂是
②用图1所示仪器组装一套可以随时添加液体试剂的发生装置,需要用到的仪器有
(2)如图2所示,进行验证CO₂能与水反应生成酸性物质的实验。
①试管中的物质X为
②通入CO₂后可观察到的现象为
(3)下列反应均能生成CO₂。
A. 木炭燃烧
B. 碳酸钠与稀硫酸反应
C. 石灰石高温分解
D. CO与氧化铁高温下反应
①其中最适合用于实验室制取CO₂的是
②你选择的反应适合用于实验室制取CO₂的主要理由是
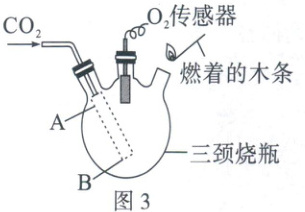
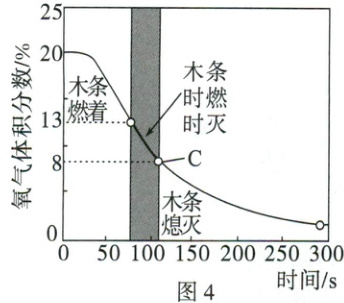
(4)收集CO₂时,常用燃着的木条放在集气瓶口验满。木条熄灭,CO₂真的集满了吗?如图3,向三颈烧瓶中持续通CO₂,测定瓶内氧气体积分数的变化情况,并用燃着的木条置于瓶口观察其是否熄灭,结果如图4所示。
①图3中,通CO₂导管的末端应处于
②图4所示C点处燃着的木条熄灭,此时三颈烧瓶内CO₂的体积分数约为

(1)该同学拟用块状石灰石制CO₂。
①应选用的另一种试剂是
稀盐酸
(填名称)。②用图1所示仪器组装一套可以随时添加液体试剂的发生装置,需要用到的仪器有
AC
(填字母)。(2)如图2所示,进行验证CO₂能与水反应生成酸性物质的实验。
①试管中的物质X为
滴有紫色石蕊溶液的水
。②通入CO₂后可观察到的现象为
溶液由紫色变为红色
。(3)下列反应均能生成CO₂。
A. 木炭燃烧
B. 碳酸钠与稀硫酸反应
C. 石灰石高温分解
D. CO与氧化铁高温下反应
①其中最适合用于实验室制取CO₂的是
B
(填字母)。②你选择的反应适合用于实验室制取CO₂的主要理由是
制得的$\mathrm{CO_2}$较纯净;常温进行,操作方便(合理即可)
(写两条)。(4)收集CO₂时,常用燃着的木条放在集气瓶口验满。木条熄灭,CO₂真的集满了吗?如图3,向三颈烧瓶中持续通CO₂,测定瓶内氧气体积分数的变化情况,并用燃着的木条置于瓶口观察其是否熄灭,结果如图4所示。
①图3中,通CO₂导管的末端应处于
B
(选填“A”或“B”)位置。②图4所示C点处燃着的木条熄灭,此时三颈烧瓶内CO₂的体积分数约为
$60\%$(或$61.9\%$)
。

答案:
(1)①稀盐酸 ②AC
(2)①滴有紫色石蕊溶液的水 ②溶液由紫色变为红色
(3)①B ②制得的$\mathrm{CO_2}$较纯净;常温进行,操作方便(合理即可)
(4)①B ②$60\%$(或$61.9\%$)
[解析]
(1)①实验室常用主要成分是碳酸钙的石灰石与稀盐酸在常温下反应制取$\mathrm{CO_2}$气体。②在实验室制取$\mathrm{CO_2}$的发生装置中,若使用长颈漏斗,可随时添加液体试剂,故可选A锥形瓶作反应容器、C带长颈漏斗和导管的双孔橡胶塞组装发生装置。
(2)①紫色石蕊溶液在酸性溶液中显红色,若要验证$\mathrm{CO_2}$和水反应能生成酸性物质,则图示试管中应盛放滴有紫色石蕊溶液的水。②通入$\mathrm{CO_2}$气体后,$\mathrm{CO_2}$与水反应生成酸性物质,使其中的紫色石蕊溶液变红色,即观察到的现象为溶液由紫色变为红色。
(3)①木炭燃烧能生成$\mathrm{CO_2}$,但反应时需有氧气参加,因此会使制得的气体中混有氧气等,不适合实验室制取$\mathrm{CO_2}$,A不符合题意;碳酸钠和稀硫酸在常温下反应生成$\mathrm{CO_2}$气体,适用于实验室制取$\mathrm{CO_2}$气体,B符合题意;石灰石高温分解能生成$\mathrm{CO_2}$气体,但反应需在高温下进行,不适合实验室制取$\mathrm{CO_2}$气体,C不符合题意;$\mathrm{CO}$和氧化铁在高温条件下反应能生成$\mathrm{CO_2}$气体,但反应需在高温下进行,且制得$\mathrm{CO_2}$中会混有未完全反应的$\mathrm{CO}$气体,使制得的气体不纯,D不符合题意。②使用碳酸钠和稀硫酸反应制取$\mathrm{CO_2}$气体时,具有反应在常温下进行且操作方便,制得的$\mathrm{CO_2}$较纯净等优点。
(4)①$\mathrm{CO_2}$的密度大于空气,需用向上排空气法收集;若要收集较纯净的$\mathrm{CO_2}$气体,伸入收集装置内的导管应伸入容器的底部,即通$\mathrm{CO_2}$导管的末端应处于图示B处位置。②图示C点时燃着的木条熄灭,其中氧气的体积分数为$8\%$;根据空气中氧气的体积分数约为$\frac{1}{5}$(或$21\%$),则三颈烧瓶内剩余空气的体积分数约为$8\% ÷ \frac{1}{5} = 40\%[或(8\% ÷ 21\%) × 100\% \approx 38.1\%]$,则此时三颈烧瓶内$\mathrm{CO_2}$的体积分数约为$1 - 40\% = 60\%$(或$1 - 38.1\% = 61.9\%$)。
(1)①稀盐酸 ②AC
(2)①滴有紫色石蕊溶液的水 ②溶液由紫色变为红色
(3)①B ②制得的$\mathrm{CO_2}$较纯净;常温进行,操作方便(合理即可)
(4)①B ②$60\%$(或$61.9\%$)
[解析]
(1)①实验室常用主要成分是碳酸钙的石灰石与稀盐酸在常温下反应制取$\mathrm{CO_2}$气体。②在实验室制取$\mathrm{CO_2}$的发生装置中,若使用长颈漏斗,可随时添加液体试剂,故可选A锥形瓶作反应容器、C带长颈漏斗和导管的双孔橡胶塞组装发生装置。
(2)①紫色石蕊溶液在酸性溶液中显红色,若要验证$\mathrm{CO_2}$和水反应能生成酸性物质,则图示试管中应盛放滴有紫色石蕊溶液的水。②通入$\mathrm{CO_2}$气体后,$\mathrm{CO_2}$与水反应生成酸性物质,使其中的紫色石蕊溶液变红色,即观察到的现象为溶液由紫色变为红色。
(3)①木炭燃烧能生成$\mathrm{CO_2}$,但反应时需有氧气参加,因此会使制得的气体中混有氧气等,不适合实验室制取$\mathrm{CO_2}$,A不符合题意;碳酸钠和稀硫酸在常温下反应生成$\mathrm{CO_2}$气体,适用于实验室制取$\mathrm{CO_2}$气体,B符合题意;石灰石高温分解能生成$\mathrm{CO_2}$气体,但反应需在高温下进行,不适合实验室制取$\mathrm{CO_2}$气体,C不符合题意;$\mathrm{CO}$和氧化铁在高温条件下反应能生成$\mathrm{CO_2}$气体,但反应需在高温下进行,且制得$\mathrm{CO_2}$中会混有未完全反应的$\mathrm{CO}$气体,使制得的气体不纯,D不符合题意。②使用碳酸钠和稀硫酸反应制取$\mathrm{CO_2}$气体时,具有反应在常温下进行且操作方便,制得的$\mathrm{CO_2}$较纯净等优点。
(4)①$\mathrm{CO_2}$的密度大于空气,需用向上排空气法收集;若要收集较纯净的$\mathrm{CO_2}$气体,伸入收集装置内的导管应伸入容器的底部,即通$\mathrm{CO_2}$导管的末端应处于图示B处位置。②图示C点时燃着的木条熄灭,其中氧气的体积分数为$8\%$;根据空气中氧气的体积分数约为$\frac{1}{5}$(或$21\%$),则三颈烧瓶内剩余空气的体积分数约为$8\% ÷ \frac{1}{5} = 40\%[或(8\% ÷ 21\%) × 100\% \approx 38.1\%]$,则此时三颈烧瓶内$\mathrm{CO_2}$的体积分数约为$1 - 40\% = 60\%$(或$1 - 38.1\% = 61.9\%$)。
查看更多完整答案,请扫码查看


