第100页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
1. 某同学在实验室里制取气体,并验证气体的某些性质,根据下图回答问题:

(1)写出仪器①的名称
(2)用高锰酸钾制取氧气,所选用的发生装置为
(3)在实验室制取和验证二氧化碳性质的实验中,装置E中蜡烛熄灭,装置F中溶液变浑浊,写出装置F中发生反应的化学方程式
(4)装置D中小试管的作用是

(1)写出仪器①的名称
锥形瓶
。(2)用高锰酸钾制取氧气,所选用的发生装置为
A
(填序号),若用G装置收集氧气,气体应从导管b
(选填“a”或“b”)通入。(3)在实验室制取和验证二氧化碳性质的实验中,装置E中蜡烛熄灭,装置F中溶液变浑浊,写出装置F中发生反应的化学方程式
$\mathrm{CO_2 + Ca(OH)_2 = CaCO_3 \downarrow + H_2O}$
。(4)装置D中小试管的作用是
形成液封,防止装置D中产生的气体从长颈漏斗逸出
。
答案:
(1)锥形瓶
(2)A b
(3)$\mathrm{CO_2 + Ca(OH)_2 = CaCO_3 \downarrow + H_2O}$
(4)形成液封,防止装置D中产生的气体从长颈漏斗逸出
(1)锥形瓶
(2)A b
(3)$\mathrm{CO_2 + Ca(OH)_2 = CaCO_3 \downarrow + H_2O}$
(4)形成液封,防止装置D中产生的气体从长颈漏斗逸出
2. 实验室常用图A或B装置作为气体的发生装置,请回答下列问题。
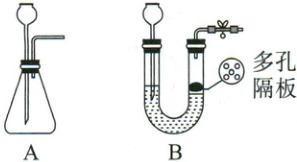
(1)用石灰石和稀盐酸制取二氧化碳的化学方程式
(2)若选用B装置,稀盐酸可通过
(3)兴趣小组的同学们打算利用课余时间用医用双氧水和生土豆片制氧气,生土豆片的作用可能是

(1)用石灰石和稀盐酸制取二氧化碳的化学方程式
$\mathrm{CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow}$
。(2)若选用B装置,稀盐酸可通过
长颈漏斗
(填仪器名称)进入装置,与A装置相比,B装置的主要优点是可以控制反应的发生与停止
。(3)兴趣小组的同学们打算利用课余时间用医用双氧水和生土豆片制氧气,生土豆片的作用可能是
加快反应速率
,同学们准备了矿泉水瓶、导气管等,其中矿泉水瓶的作用可能是作发生装置(或作收集装置)
。
答案:
(1)$\mathrm{CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow}$
(2)长颈漏斗 可以控制反应的发生与停止
(3)加快反应速率 作发生装置(或作收集装置)
[解析]
(1)实验室制取$\mathrm{CO_2}$是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式是$\mathrm{CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow}$。
(2)选用B装置,稀盐酸可通过长颈漏斗进入装置。与A装置相比,B装置的主要优点是B带有弹簧夹和多孔隔板,关闭弹簧夹,内部气体增多,压强增大,液体被压入长颈漏斗,固液分离,反应停止,打开弹簧夹,气体输出,压强减小,液体重新进入试管,固液接触,反应发生,故可以控制反应的发生与停止。
(3)过氧化氢在常温时放出氧气很慢,所以加入生土豆片的作用可能是加快反应速率,过氧化氢在生土豆片的作用下分解产生氧气,属于固液常温型发生装置,则矿泉水瓶的作用可能是作为发生装置,同时也可以用作收集装置。
(1)$\mathrm{CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow}$
(2)长颈漏斗 可以控制反应的发生与停止
(3)加快反应速率 作发生装置(或作收集装置)
[解析]
(1)实验室制取$\mathrm{CO_2}$是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式是$\mathrm{CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow}$。
(2)选用B装置,稀盐酸可通过长颈漏斗进入装置。与A装置相比,B装置的主要优点是B带有弹簧夹和多孔隔板,关闭弹簧夹,内部气体增多,压强增大,液体被压入长颈漏斗,固液分离,反应停止,打开弹簧夹,气体输出,压强减小,液体重新进入试管,固液接触,反应发生,故可以控制反应的发生与停止。
(3)过氧化氢在常温时放出氧气很慢,所以加入生土豆片的作用可能是加快反应速率,过氧化氢在生土豆片的作用下分解产生氧气,属于固液常温型发生装置,则矿泉水瓶的作用可能是作为发生装置,同时也可以用作收集装置。
3. (2025·赣水学考联盟一模)实验室用下图所示装置制取CO₂气体,并进行相关性质探究。已知:CO₂不能与饱和NaHCO₃溶液发生反应。据图回答问题:

(1)装置B是在装置A基础上的改进,其优点是
(2)向装置B中
(3)若装置C内盛放饱和NaHCO₃溶液,其作用是
(4)若装置C用来干燥CO₂,装置C中应盛放的试剂是
(5)将纯净干燥的CO₂缓慢通入装置D中,则玻璃管内的干燥纸花

(1)装置B是在装置A基础上的改进,其优点是
可以通过活塞控制反应的发生和停止
。(2)向装置B中
长颈漏斗
(填仪器名称)内加入稀盐酸,发生反应的化学方程式为$\mathrm{CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow}$
。(3)若装置C内盛放饱和NaHCO₃溶液,其作用是
除去二氧化碳中混有的氯化氢气体
。(4)若装置C用来干燥CO₂,装置C中应盛放的试剂是
浓硫酸
。(5)将纯净干燥的CO₂缓慢通入装置D中,则玻璃管内的干燥纸花
始终未变色
(选填“变红”或“始终未变色”),塑料瓶内的下方纸花先变红色
(选填“先变红色”或“后变红色”)。
答案:
(1)可以通过活塞控制反应的发生和停止
(2)长颈漏斗 $\mathrm{CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow}$
(3)除去二氧化碳中混有的氯化氢气体
(4)浓硫酸
(5)始终未变色 先变红色
[解析]
(1)在装置B中,固体药品放在多孔隔板上,液体药品从长颈漏斗中加入。反应开始后,关闭弹簧夹时,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止,打开开关时,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行;装置B的优点是:可以通过活塞控制反应的发生和停止。
(2)实验室制取二氧化碳,常用大理石或石灰石与盐酸反应,向装置B中长颈漏斗内加入稀盐酸,大理石的主要成分碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,化学方程式为$\mathrm{CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow}$。
(3)装置C内盛放饱和$\mathrm{NaHCO_3}$溶液的作用是除去二氧化碳中混有的氯化氢气体。因为盐酸具有挥发性,制取的二氧化碳中会混有氯化氢气体,氯化氢会与饱和$\mathrm{NaHCO_3}$溶液反应,而二氧化碳不与饱和$\mathrm{NaHCO_3}$溶液反应,从而达到除杂的目的。
(4)若装置C用来干燥$\mathrm{CO_2}$,装置C中应盛放的试剂是浓硫酸。浓硫酸具有吸水性,且不与二氧化碳发生反应,能将二氧化碳中的水分吸收,从而得到干燥的二氧化碳。
(5)将纯净干燥的$\mathrm{CO_2}$缓慢通入装置D中,则玻璃管内的干燥纸花始终未变色,因为干燥的二氧化碳不能使干燥的石蕊纸花变红;塑料瓶内的下方纸花先变红色,因为二氧化碳密度比空气大,会先接触下方纸花,且二氧化碳与水反应生成碳酸,碳酸能使石蕊变红。
(1)可以通过活塞控制反应的发生和停止
(2)长颈漏斗 $\mathrm{CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow}$
(3)除去二氧化碳中混有的氯化氢气体
(4)浓硫酸
(5)始终未变色 先变红色
[解析]
(1)在装置B中,固体药品放在多孔隔板上,液体药品从长颈漏斗中加入。反应开始后,关闭弹簧夹时,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止,打开开关时,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行;装置B的优点是:可以通过活塞控制反应的发生和停止。
(2)实验室制取二氧化碳,常用大理石或石灰石与盐酸反应,向装置B中长颈漏斗内加入稀盐酸,大理石的主要成分碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,化学方程式为$\mathrm{CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow}$。
(3)装置C内盛放饱和$\mathrm{NaHCO_3}$溶液的作用是除去二氧化碳中混有的氯化氢气体。因为盐酸具有挥发性,制取的二氧化碳中会混有氯化氢气体,氯化氢会与饱和$\mathrm{NaHCO_3}$溶液反应,而二氧化碳不与饱和$\mathrm{NaHCO_3}$溶液反应,从而达到除杂的目的。
(4)若装置C用来干燥$\mathrm{CO_2}$,装置C中应盛放的试剂是浓硫酸。浓硫酸具有吸水性,且不与二氧化碳发生反应,能将二氧化碳中的水分吸收,从而得到干燥的二氧化碳。
(5)将纯净干燥的$\mathrm{CO_2}$缓慢通入装置D中,则玻璃管内的干燥纸花始终未变色,因为干燥的二氧化碳不能使干燥的石蕊纸花变红;塑料瓶内的下方纸花先变红色,因为二氧化碳密度比空气大,会先接触下方纸花,且二氧化碳与水反应生成碳酸,碳酸能使石蕊变红。
查看更多完整答案,请扫码查看


