第17页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
8. (2025·连云港)氢气的发现、制取、储存和利用意义重大。
(1) 发现氢气:16 世纪科学家就发现稀 H₂SO₄与 Fe 反应能生成“易燃空气”。1787 年拉瓦锡将 H₂O(g)[表示水蒸气]通过一根烧红的铁制枪管,得同样“易燃空气”。他将“易燃空气”命名为“生成水的元素”,即氢。拉瓦锡实验中,枪管内壁有黑色固体(Fe₃O₄)生成,该反应的化学方程式为_。
(2) 制取氢气:一种以 NiFe₂O₄为催化剂制氢的反应原理如图甲所示。
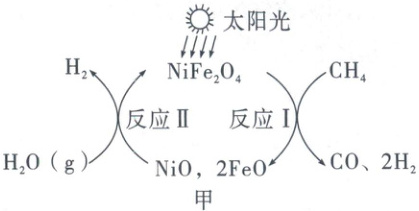
①反应Ⅰ中
②将 16 g CH₄和足量的 H₂O(g)通过该方法制氢,理论上可获得_g
(3) 储存氢气:镁基材料固态储氢具有储量大、安全等优点。储氢时,Mg 与 H₂在一定条件下反应生成 MgH₂固体。1 m³镁基材料储存的 H₂在常温常压下体积可达 1345 m³。
①MgH₂由两种离子按个数比 1:2 构成。构成 MgH₂的是
②镁基材料储氢量大的原因是_。
(4) 利用氢气:氢氧燃料电池能将化学能转化为电能,工作原理如图乙所示。
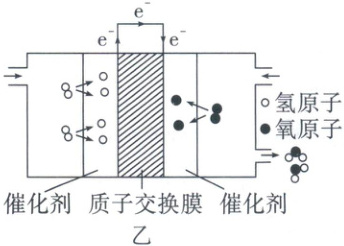
①质子交换膜中只允许一种微观粒子通过,该微观粒子为_(填字母)。
A. e⁻ B. H⁺ C. O²⁻
②燃料电池中发生反应的化学方程式为_。
(1) 发现氢气:16 世纪科学家就发现稀 H₂SO₄与 Fe 反应能生成“易燃空气”。1787 年拉瓦锡将 H₂O(g)[表示水蒸气]通过一根烧红的铁制枪管,得同样“易燃空气”。他将“易燃空气”命名为“生成水的元素”,即氢。拉瓦锡实验中,枪管内壁有黑色固体(Fe₃O₄)生成,该反应的化学方程式为_。
$3Fe + 4H_2O(g)\xlongequal{高温}Fe_3O_4 + 4H_2$
(2) 制取氢气:一种以 NiFe₂O₄为催化剂制氢的反应原理如图甲所示。

①反应Ⅰ中
参加
NiFe₂O₄_(选填“参加”或“未参加”)化学反应。②将 16 g CH₄和足量的 H₂O(g)通过该方法制氢,理论上可获得_g
6
H₂。(3) 储存氢气:镁基材料固态储氢具有储量大、安全等优点。储氢时,Mg 与 H₂在一定条件下反应生成 MgH₂固体。1 m³镁基材料储存的 H₂在常温常压下体积可达 1345 m³。
①MgH₂由两种离子按个数比 1:2 构成。构成 MgH₂的是
$H^-$
Mg²⁺和_(填离子符号)。②镁基材料储氢量大的原因是_。
$H_2$转化为固体,等质量气体体积可缩小1000多倍
(4) 利用氢气:氢氧燃料电池能将化学能转化为电能,工作原理如图乙所示。

①质子交换膜中只允许一种微观粒子通过,该微观粒子为_(填字母)。
A. e⁻ B. H⁺ C. O²⁻
②燃料电池中发生反应的化学方程式为_。
B
$2H_2 + O_2 \xlongequal{催化剂}2H_2O$
答案:
8.
(1)$3Fe + 4H_2O(g)\xlongequal{高温}Fe_3O_4 + 4H_2$
(2)①参加 ②6
(3)①$H^-$ ②$H_2$转化为固体,等质量气体体积可缩小1000多倍
(4)①B ②$2H_2 + O_2 \xlongequal{催化剂}2H_2O$ [解析]
(1)高温条件下,水蒸气和铁反应生成四氧化三铁和氢气,该反应的化学方程式为$3Fe + 4H_2O(g)\xlongequal{高温}Fe_3O_4 + 4H_2$。
(2)①由题图甲可知,反应Ⅰ中$NiFe_2O_4$参加了化学反应。 ②$CH_4 + H_2O \xlongequal{一定条件}CO + 3H_2$,反应中$CH_4$、$H_2$的质量比为16∶6,故将16g$CH_4$和足量的$H_2O(g)$通过该方法制氢,理论上可获得6g$H_2$。
(3)①$MgH_2$由两种离子按个数比1∶2构成,故构成$MgH_2$的是$Mg^{2+}$和$H^-$。 ②题目中明确给出“$Mg$与$H_2$在一定条件下反应生成$MgH_2$固体。 1m³镁基材料储存的$H_2$在常温常压下体积可达1345m³”,说明$H_2$转化为固体,等质量气体体积可缩小1000多倍,所以镁基材料储氢量大。
(4)①质子交换膜中只允许一种微观粒子通过,该微观粒子为$H^+$($H$原子失去1个电子后相当于一个质子)。 ②燃料电池中,氢气和氧气在催化剂的条件下生成水,发生反应的化学方程式为$2H_2 + O_2 \xlongequal{催化剂}2H_2O$。
(1)$3Fe + 4H_2O(g)\xlongequal{高温}Fe_3O_4 + 4H_2$
(2)①参加 ②6
(3)①$H^-$ ②$H_2$转化为固体,等质量气体体积可缩小1000多倍
(4)①B ②$2H_2 + O_2 \xlongequal{催化剂}2H_2O$ [解析]
(1)高温条件下,水蒸气和铁反应生成四氧化三铁和氢气,该反应的化学方程式为$3Fe + 4H_2O(g)\xlongequal{高温}Fe_3O_4 + 4H_2$。
(2)①由题图甲可知,反应Ⅰ中$NiFe_2O_4$参加了化学反应。 ②$CH_4 + H_2O \xlongequal{一定条件}CO + 3H_2$,反应中$CH_4$、$H_2$的质量比为16∶6,故将16g$CH_4$和足量的$H_2O(g)$通过该方法制氢,理论上可获得6g$H_2$。
(3)①$MgH_2$由两种离子按个数比1∶2构成,故构成$MgH_2$的是$Mg^{2+}$和$H^-$。 ②题目中明确给出“$Mg$与$H_2$在一定条件下反应生成$MgH_2$固体。 1m³镁基材料储存的$H_2$在常温常压下体积可达1345m³”,说明$H_2$转化为固体,等质量气体体积可缩小1000多倍,所以镁基材料储氢量大。
(4)①质子交换膜中只允许一种微观粒子通过,该微观粒子为$H^+$($H$原子失去1个电子后相当于一个质子)。 ②燃料电池中,氢气和氧气在催化剂的条件下生成水,发生反应的化学方程式为$2H_2 + O_2 \xlongequal{催化剂}2H_2O$。
查看更多完整答案,请扫码查看


