第45页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
1. (2025·安徽)由下列实验操作和现象,得出的结论正确的是(

B
)
答案:
1. B [解析]将黄铜片和铜片互相刻画,铜片上出现划痕,说明黄铜的硬度大于铜,A错误;取一小片氢氧化钠固体放在表面皿上,放置一会儿,固体表面变潮湿,说明氢氧化钠易潮解,B正确;向硫酸铜溶液中滴加某溶液,产生蓝色沉淀,该溶液中一定有氢氧根离子,但不一定含氢氧化钾,C错误;向充满二氧化碳的质地较软塑料瓶中加入一定量的水,立即旋紧瓶塞、振荡,塑料瓶变瘪,不能得出二氧化碳与水发生化学反应的结论,产生该现象也可能是二氧化碳溶于水导致瓶内气压减小,D错误。
2. (2023·安徽)已知草酸钙(CaC₂O₄)加热易分解:$CaC₂O₄\xlongequal{\triangle}CaO + CO↑ + CO₂↑。$为验证分解产物中既有CO又有CO₂,小明设计如下实验装置。
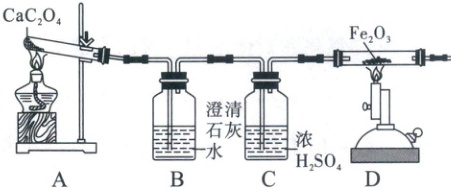
回答下列问题。
(1)B中实验现象是_;写出D中发生反应的化学方程式:_。
(2)Fe₂O₃中铁元素化合价为_价。
(3)小华认为,在D装置后再增加装置B才能验证CO的存在,小明认为不加装置B就可验证,小明的理由是_。
(4)从环保的角度考虑,该实验装置的不足之处是_。

回答下列问题。
(1)B中实验现象是_;写出D中发生反应的化学方程式:_。
澄清石灰水变浑浊
(2)Fe₂O₃中铁元素化合价为_价。
$Fe_{2}O_{3} + 3CO\stackrel{高温}{=}2Fe + 3CO_{2}$
(3)小华认为,在D装置后再增加装置B才能验证CO的存在,小明认为不加装置B就可验证,小明的理由是_。
+3
(4)从环保的角度考虑,该实验装置的不足之处是_。
D中红棕色固体变黑色
缺少尾气处理装置
答案:
2.
(1)澄清石灰水变浑浊 $Fe_{2}O_{3} + 3CO\stackrel{高温}{=}2Fe + 3CO_{2}$
(2)+3
(3)D中红棕色固体变黑色
(4)缺少尾气处理装置
[解析]
(1)草酸钙分解产生CO和$CO_{2}$,其中$CO_{2}$使澄清石灰水变浑浊;D中氧化铁和一氧化碳反应的化学方程式为$Fe_{2}O_{3} + 3CO\stackrel{高温}{=}2Fe + 3CO_{2}$。
(2)$Fe_{2}O_{3}$中氧元素化合价为-2价,设铁元素化合价为x价,根据化合物中各元素正负化合价代数和为零可得$2x + (-2)×3 = 0$,得出$x = +3$,即$Fe_{2}O_{3}$中铁元素的化合价为+3价。
(3)一氧化碳具有还原性,可以将氧化铁(红棕色)还原为铁粉(黑色),所以从玻璃管中的现象就可验证一氧化碳的存在。
(4)由于分解产物中含有一氧化碳,直接排放会污染空气,所以在D之后要加尾气处理装置,以免污染空气。
(1)澄清石灰水变浑浊 $Fe_{2}O_{3} + 3CO\stackrel{高温}{=}2Fe + 3CO_{2}$
(2)+3
(3)D中红棕色固体变黑色
(4)缺少尾气处理装置
[解析]
(1)草酸钙分解产生CO和$CO_{2}$,其中$CO_{2}$使澄清石灰水变浑浊;D中氧化铁和一氧化碳反应的化学方程式为$Fe_{2}O_{3} + 3CO\stackrel{高温}{=}2Fe + 3CO_{2}$。
(2)$Fe_{2}O_{3}$中氧元素化合价为-2价,设铁元素化合价为x价,根据化合物中各元素正负化合价代数和为零可得$2x + (-2)×3 = 0$,得出$x = +3$,即$Fe_{2}O_{3}$中铁元素的化合价为+3价。
(3)一氧化碳具有还原性,可以将氧化铁(红棕色)还原为铁粉(黑色),所以从玻璃管中的现象就可验证一氧化碳的存在。
(4)由于分解产物中含有一氧化碳,直接排放会污染空气,所以在D之后要加尾气处理装置,以免污染空气。
3. (2022·安徽)海洋封存是实现“碳中和”的途径之一,其原理是利用CO₂在水等溶剂中的溶解性来吸收CO₂。某小组开展如下探究。
【活动一】探究CO₂在水和食盐水(模拟海水)中的溶解情况
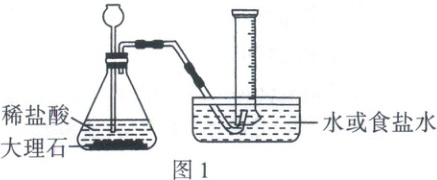
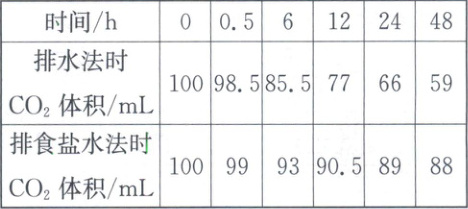
相同条件下,该小组分别用排水法、排食盐水法收集CO₂(如图1),待收集100 mL CO₂后,移出导管,每隔一段时间观察并记录量筒内CO₂的体积。重复实验,所测数据平均值如下表。
(1)图1发生装置中反应的化学方程式为_,反应类型是_。
(2)由上表数据分析:
①能用排水法收集CO₂的理由是_。
②相同条件下,等体积水和食盐水吸收CO₂更多的是_(选填“水”或“食盐水”)。
(3)海洋封存CO₂,可能带来的危害是_(写出1点即可)。
【活动二】探究植物油隔离对CO₂在水中溶解情况的影响
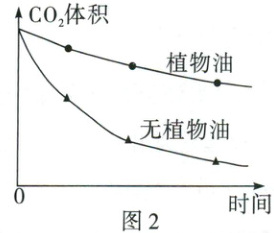
(4)小方设计并完成以下对照实验:用两个量筒分别收集100 mL CO₂倒置于水槽中,向其中一个量筒内注入少量植物油,使CO₂与水被植物油隔开(CO₂与植物油不反应),测得量筒内CO₂体积随时间变化曲线如图2。分析该图可得出的结论是_。
【活动三】深度探究【活动二】中CO₂的溶解情况
(5)①小松用图3表示无植物油隔离时,量筒内气体中存在的CO₂分子的微观示意图。请参照图3的表示方式,在图4方框中画出有植物油隔离时,量筒内植物油和水中存在的分子的微观示意图(植物油分子用“油”表示)。
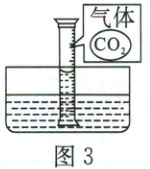
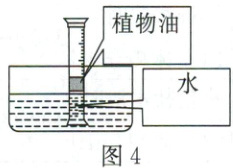
②为检验有植物油隔离时CO₂是否会进入水中,请设计实验方案:_。
【活动一】探究CO₂在水和食盐水(模拟海水)中的溶解情况

相同条件下,该小组分别用排水法、排食盐水法收集CO₂(如图1),待收集100 mL CO₂后,移出导管,每隔一段时间观察并记录量筒内CO₂的体积。重复实验,所测数据平均值如下表。

(1)图1发生装置中反应的化学方程式为_,反应类型是_。
(2)由上表数据分析:
①能用排水法收集CO₂的理由是_。
②相同条件下,等体积水和食盐水吸收CO₂更多的是_(选填“水”或“食盐水”)。
(3)海洋封存CO₂,可能带来的危害是_(写出1点即可)。
【活动二】探究植物油隔离对CO₂在水中溶解情况的影响

(4)小方设计并完成以下对照实验:用两个量筒分别收集100 mL CO₂倒置于水槽中,向其中一个量筒内注入少量植物油,使CO₂与水被植物油隔开(CO₂与植物油不反应),测得量筒内CO₂体积随时间变化曲线如图2。分析该图可得出的结论是_。
【活动三】深度探究【活动二】中CO₂的溶解情况
(5)①小松用图3表示无植物油隔离时,量筒内气体中存在的CO₂分子的微观示意图。请参照图3的表示方式,在图4方框中画出有植物油隔离时,量筒内植物油和水中存在的分子的微观示意图(植物油分子用“油”表示)。


②为检验有植物油隔离时CO₂是否会进入水中,请设计实验方案:_。
答案:
3.
(1)$CaCO_{3} + 2HCl = CaCl_{2} + H_{2}O + CO_{2}\uparrow$ 复分解反应
(2)①二氧化碳溶于水的速度远小于二氧化碳逸出的速度
②水
(3)改变海水的pH,危害海洋生物健康
(4)植物油可以减缓二氧化碳在水中的溶解
(5)①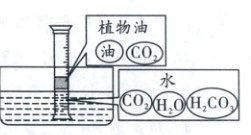
②取量筒内的少量水于试管中,滴加紫色石蕊溶液,若溶液变红,说明二氧化碳进入水中(合理即可)
[解析]
(1)碳酸钙与稀盐酸反应,是两种化合物互相交换成分生成两种新的化合物的反应,属于复分解反应。
(2)①由表中数据可知,48小时后,与水接触的量筒内剩余二氧化碳的体积为59 mL,说明二氧化碳在水中的溶解速率较慢,远小于二氧化碳的产生速率,因此可以用排水法收集二氧化碳。②由表中数据可知,排水法时二氧化碳的体积减小得更快,排食盐水法时二氧化碳的体积减小得较慢,说明相同条件下,等体积水和食盐水吸收$CO_{2}$更多的是水。
(3)二氧化碳和水反应生成碳酸,碳酸呈酸性,可能会改变海水的pH,造成海洋系统环境改变,危害海洋生物健康。
(4)由题图2可知,相同时间内,有植物油的量筒中二氧化碳减少得较慢,可以得出植物油可减缓二氧化碳在水中的溶解。
(5)①分子在不断运动,从[活动二]可知,二氧化碳分子会进入水和油中,植物油中有油分子和二氧化碳分子,水中有水分子、二氧化碳分子及二氧化碳与水反应生成的碳酸分子。②二氧化碳进入水中会与水反应生成碳酸,溶液呈酸性,可使紫色石蕊溶液变红色,可根据此性质设计实验。
3.
(1)$CaCO_{3} + 2HCl = CaCl_{2} + H_{2}O + CO_{2}\uparrow$ 复分解反应
(2)①二氧化碳溶于水的速度远小于二氧化碳逸出的速度
②水
(3)改变海水的pH,危害海洋生物健康
(4)植物油可以减缓二氧化碳在水中的溶解
(5)①

②取量筒内的少量水于试管中,滴加紫色石蕊溶液,若溶液变红,说明二氧化碳进入水中(合理即可)
[解析]
(1)碳酸钙与稀盐酸反应,是两种化合物互相交换成分生成两种新的化合物的反应,属于复分解反应。
(2)①由表中数据可知,48小时后,与水接触的量筒内剩余二氧化碳的体积为59 mL,说明二氧化碳在水中的溶解速率较慢,远小于二氧化碳的产生速率,因此可以用排水法收集二氧化碳。②由表中数据可知,排水法时二氧化碳的体积减小得更快,排食盐水法时二氧化碳的体积减小得较慢,说明相同条件下,等体积水和食盐水吸收$CO_{2}$更多的是水。
(3)二氧化碳和水反应生成碳酸,碳酸呈酸性,可能会改变海水的pH,造成海洋系统环境改变,危害海洋生物健康。
(4)由题图2可知,相同时间内,有植物油的量筒中二氧化碳减少得较慢,可以得出植物油可减缓二氧化碳在水中的溶解。
(5)①分子在不断运动,从[活动二]可知,二氧化碳分子会进入水和油中,植物油中有油分子和二氧化碳分子,水中有水分子、二氧化碳分子及二氧化碳与水反应生成的碳酸分子。②二氧化碳进入水中会与水反应生成碳酸,溶液呈酸性,可使紫色石蕊溶液变红色,可根据此性质设计实验。
查看更多完整答案,请扫码查看


