第61页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
3. (2020·安徽)金属防腐是科学研究中的重大课题。某校学习小组以铁的腐蚀为项目进行如下研究。
【认识铁的腐蚀】
(1) 下列环境中的铁制品最容易生锈的是_(填字母)。
A. 未擦干的铁锅
B. 涂油漆的栏杆
C. 盛水的不锈钢水杯
(2) 铁锈的主要成分是$F{e}_{2}{O}_{3}· x{H}_{2}O$,其中铁元素的化合价是_价。
【探究铁的腐蚀】
(3) 该小组用下图甲装置进行实验,起始时量筒内水面处于$50mL$刻度处,之后水面缓慢上升。几天后水面最终处于约_(选填“$40$”或“$10$”) $mL$刻度处,原因是_。
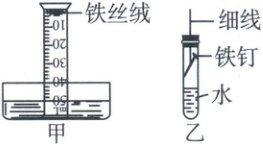
【拓展探究】
(4) 小强同学进行如下实验:取铁钉用砂纸打磨,称其质量,按上图乙安装装置,放置$3$天,再取出铁钉称量。在不同温度下重复上述实验,得到铁钉质量增加情况如下表。

小强同学的实验是探究_因素对铁钉腐蚀快慢的影响,结论是_。
(5) 有同学认为小强的实验未能真实反映$50^{\circ }C$以后铁钉腐蚀的快慢,理由是$50^{\circ }C$以后铁钉质量没有变化。请分析铁钉质量没有变化的原因:_;改进实验方案证明你的分析:_。
【认识铁的腐蚀】
(1) 下列环境中的铁制品最容易生锈的是_(填字母)。
A. 未擦干的铁锅
B. 涂油漆的栏杆
C. 盛水的不锈钢水杯
(2) 铁锈的主要成分是$F{e}_{2}{O}_{3}· x{H}_{2}O$,其中铁元素的化合价是_价。
【探究铁的腐蚀】
(3) 该小组用下图甲装置进行实验,起始时量筒内水面处于$50mL$刻度处,之后水面缓慢上升。几天后水面最终处于约_(选填“$40$”或“$10$”) $mL$刻度处,原因是_。

【拓展探究】
(4) 小强同学进行如下实验:取铁钉用砂纸打磨,称其质量,按上图乙安装装置,放置$3$天,再取出铁钉称量。在不同温度下重复上述实验,得到铁钉质量增加情况如下表。

小强同学的实验是探究_因素对铁钉腐蚀快慢的影响,结论是_。
(5) 有同学认为小强的实验未能真实反映$50^{\circ }C$以后铁钉腐蚀的快慢,理由是$50^{\circ }C$以后铁钉质量没有变化。请分析铁钉质量没有变化的原因:_;改进实验方案证明你的分析:_。
答案:
3.
(1)A
(2)+3
(3)40 铁腐蚀消耗氧气,且氧气约占空气总体积的$\frac{1}{5}$
(4)温度 其他条件相同时,温度在10~50℃的范围内,温度越高,铁钉腐蚀的速度越快
(5)试管内的氧气已耗尽,剩余的铁不能继续锈蚀
取容积更大的密闭容器,加入与乙装置中相同量、相同种类的铁钉与水,在50℃的环境中放置3天,若铁钉增加的质量大于0.18g,则分析成立(合理即可)
[解析]
(1)铁生锈的条件是与氧气和水同时接触。未擦干的铁锅中铁与水和氧气同时接触易生锈,A正确;涂油漆的栏杆隔绝氧气和水不易生锈,B错误;不锈钢不易生锈,C错误。
(2)依据在化合物中正负化合价的代数和为零,根据铁锈的化学式Fe₂O₃·xH₂O,设铁元素化合价为a,2a+3×(-2)+x[(+1)×2+(-2)]=0,解得a=+3。
(3)因为铁丝绒生锈消耗试管内的氧气,又知空气中的氧气约占空气总体积的$\frac{1}{5},$可知50mL量筒内氧气的体积约为$50mL×\frac{1}{5}=10mL,$故反应结束后,量筒内气体减少约10mL,故最终液面停留在40mL刻度处。
(4)分析表格中的数据可推知实验探究的因素为温度,其实验结论为在其他条件相同时,温度在10~50℃的范围内,温度越高,铁钉腐蚀的速度越快。
(5)分析10~50℃的数据,易知铁腐蚀的快慢跟温度呈正向关系。可以推知,50℃以上时,铁腐蚀的速率也应当呈现这种关系,但要注意到,生成物的质量增加,不仅与反应速率有关,还和反应物的量有关。当反应物中的某一种完全消耗后,反应停止,则生成物的量也不再改变。在试管内,氧气的量是非常有限的,由于温度高,反应速率快,氧气很快被消耗完,反应停止。为解决这一问题,可换用容积更大的密闭容器重复实验,在50℃的环境中放置3天,若铁钉增加的质量大于0.18g,则分析成立(合理即可)。
(1)A
(2)+3
(3)40 铁腐蚀消耗氧气,且氧气约占空气总体积的$\frac{1}{5}$
(4)温度 其他条件相同时,温度在10~50℃的范围内,温度越高,铁钉腐蚀的速度越快
(5)试管内的氧气已耗尽,剩余的铁不能继续锈蚀
取容积更大的密闭容器,加入与乙装置中相同量、相同种类的铁钉与水,在50℃的环境中放置3天,若铁钉增加的质量大于0.18g,则分析成立(合理即可)
[解析]
(1)铁生锈的条件是与氧气和水同时接触。未擦干的铁锅中铁与水和氧气同时接触易生锈,A正确;涂油漆的栏杆隔绝氧气和水不易生锈,B错误;不锈钢不易生锈,C错误。
(2)依据在化合物中正负化合价的代数和为零,根据铁锈的化学式Fe₂O₃·xH₂O,设铁元素化合价为a,2a+3×(-2)+x[(+1)×2+(-2)]=0,解得a=+3。
(3)因为铁丝绒生锈消耗试管内的氧气,又知空气中的氧气约占空气总体积的$\frac{1}{5},$可知50mL量筒内氧气的体积约为$50mL×\frac{1}{5}=10mL,$故反应结束后,量筒内气体减少约10mL,故最终液面停留在40mL刻度处。
(4)分析表格中的数据可推知实验探究的因素为温度,其实验结论为在其他条件相同时,温度在10~50℃的范围内,温度越高,铁钉腐蚀的速度越快。
(5)分析10~50℃的数据,易知铁腐蚀的快慢跟温度呈正向关系。可以推知,50℃以上时,铁腐蚀的速率也应当呈现这种关系,但要注意到,生成物的质量增加,不仅与反应速率有关,还和反应物的量有关。当反应物中的某一种完全消耗后,反应停止,则生成物的量也不再改变。在试管内,氧气的量是非常有限的,由于温度高,反应速率快,氧气很快被消耗完,反应停止。为解决这一问题,可换用容积更大的密闭容器重复实验,在50℃的环境中放置3天,若铁钉增加的质量大于0.18g,则分析成立(合理即可)。
查看更多完整答案,请扫码查看


