第56页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
6. 根据所给信息,回答下列问题。
(1)氢气是一种清洁的高能燃料,氢气在氧气中燃烧______(填“放出”或“吸收”)热量。
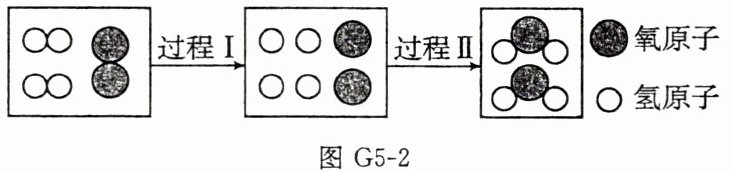
(2)图G5-2是氢气在空气中燃烧的微观示意图,从微观角度分析,过程Ⅰ表示分子分解成______的过程,该反应的化学方程式为______。
(3)氢化镁(${MgH2}$)是一种非常有发展前景的储氢材料,能与水反应生成氢氧化镁和一种常见的可燃性气体,该反应的化学方程式为______。
(1)氢气是一种清洁的高能燃料,氢气在氧气中燃烧______(填“放出”或“吸收”)热量。
(2)图G5-2是氢气在空气中燃烧的微观示意图,从微观角度分析,过程Ⅰ表示分子分解成______的过程,该反应的化学方程式为______。

(3)氢化镁(${MgH2}$)是一种非常有发展前景的储氢材料,能与水反应生成氢氧化镁和一种常见的可燃性气体,该反应的化学方程式为______。
答案:
(1)放出
(2)原子 2H₂+O₂$\frac{\underline{点燃}}{}$2H₂O
(3)MgH₂+2H₂O=Mg(OH)₂+2H₂↑
(1)放出
(2)原子 2H₂+O₂$\frac{\underline{点燃}}{}$2H₂O
(3)MgH₂+2H₂O=Mg(OH)₂+2H₂↑
7. 物质甲发生某反应的微观示意图如图G5-3所示。

(1)该反应的化学方程式是______。
(2)含3.4 g物质甲的溶液完全反应,可生成物质丙的质量是多少?(写出计算过程)

(1)该反应的化学方程式是______。
(2)含3.4 g物质甲的溶液完全反应,可生成物质丙的质量是多少?(写出计算过程)
答案:
(1)2H₂O₂$\xlongequal{MnO_2}$2H₂O+O₂↑
(2)解:由题意可知,物质丙为氧气,设生成的氧气的质量为x。
2H₂O₂$\xlongequal{MnO_2}$2H₂O+O₂↑
68 32
3.4 g x
$\frac{68}{32}$=$\frac{3.4\ g}{x}$ x=1.6 g
答:可生成物质丙的质量是1.6 g。
(1)2H₂O₂$\xlongequal{MnO_2}$2H₂O+O₂↑
(2)解:由题意可知,物质丙为氧气,设生成的氧气的质量为x。
2H₂O₂$\xlongequal{MnO_2}$2H₂O+O₂↑
68 32
3.4 g x
$\frac{68}{32}$=$\frac{3.4\ g}{x}$ x=1.6 g
答:可生成物质丙的质量是1.6 g。
8.(2024安徽改编)《天工开物》记载了锡的冶炼方法:“入砂(指锡砂)数百斤,丛架木炭亦数百斤,鼓鞴(指鼓入空气)熔化……用铅少许勾引,方始(锡)沛然流注。”其反应原理为${C + SnO2 \xlongequal{高温} Sn + CO2↑}$。现有151 kg含${SnO2}$20%的锡砂,理论上可以炼出锡的质量是多少?(写出计算过程)
答案:
解:设理论上可以炼出锡的质量为x。
C+SnO₂$\xlongequal{高温}$Sn+CO₂↑
151 119
151 kg×20% x
$\frac{151}{119}$=$\frac{151\ kg×20\%}{x}$
x=23.8 kg
答:理论上可以炼出锡的质量是23.8 kg。
C+SnO₂$\xlongequal{高温}$Sn+CO₂↑
151 119
151 kg×20% x
$\frac{151}{119}$=$\frac{151\ kg×20\%}{x}$
x=23.8 kg
答:理论上可以炼出锡的质量是23.8 kg。
9.(2024湖北)钛(Ti)和钛合金广泛用于火箭、导弹、航天飞机和通信设备等。工业上生产钛的反应为${TiCl4 + 2Mg \xlongequal{高温} 2MgCl2 + Ti}$。
(1)${TiCl4}$中钛、氯元素的质量比为______。
(2)若要生产12 t钛,至少需要镁的质量是多少?(写出计算过程)
(1)${TiCl4}$中钛、氯元素的质量比为______。
(2)若要生产12 t钛,至少需要镁的质量是多少?(写出计算过程)
答案:
(1)24:71
(2)解:设至少需要镁的质量为x。
TiCl₄+2Mg$\xlongequal{高温}$2MgCl₂+Ti
48 48
x 12 t
$\frac{48}{48}$=$\frac{x}{12\ t}$ x=12 t
答:至少需要镁的质量为12 t。
(1)24:71
(2)解:设至少需要镁的质量为x。
TiCl₄+2Mg$\xlongequal{高温}$2MgCl₂+Ti
48 48
x 12 t
$\frac{48}{48}$=$\frac{x}{12\ t}$ x=12 t
答:至少需要镁的质量为12 t。
查看更多完整答案,请扫码查看


