2025年5年高考3年模拟高中化学选择性必修第三册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学选择性必修第三册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第73页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
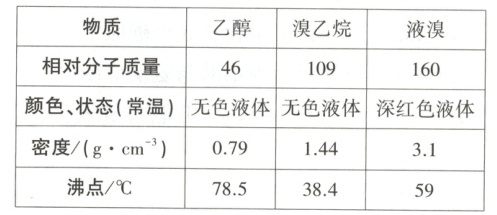
6.某兴趣小组在实验室用乙醇、浓硫酸、溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。有关数据见下表:
Ⅰ.溴乙烷的制备
反应原理如下:
$H₂SO₄ + NaBr \xrightarrow{微沸} NaHSO₄ + HBr↑$
$CH₃CH₂OH + HBr \xrightarrow{加热} CH₃CH₂Br + H₂O$
实验装置如图(加热装置、夹持装置均省略):
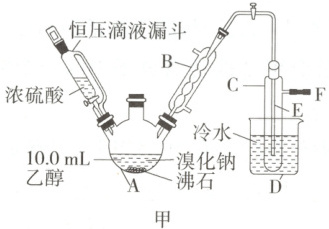
(1)图甲中仪器 B 的名称为
(2)图甲中 A 加热温度过高、浓硫酸的浓度过大,均会使 C 中收集到的粗产品呈橙色,原因是 A 中发生了副反应生成了
Ⅱ.溴乙烷性质的探究
用如图所示实验装置验证溴乙烷的性质:
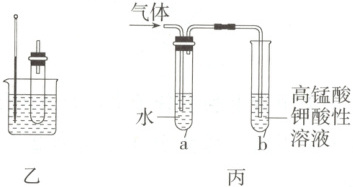
(3)在乙中试管内加入 10 mL 6 mol·L⁻¹ NaOH 溶液和 2 mL 溴乙烷,振荡、静置,液体分层,水浴加热。该过程中反应的化学方程式为
(4)若将乙中试管里的 NaOH 溶液换成 NaOH 的乙醇溶液,为证明产物为乙烯,将生成的气体通入图丙所示装置。a 试管中水的作用是

Ⅰ.溴乙烷的制备
反应原理如下:
$H₂SO₄ + NaBr \xrightarrow{微沸} NaHSO₄ + HBr↑$
$CH₃CH₂OH + HBr \xrightarrow{加热} CH₃CH₂Br + H₂O$
实验装置如图(加热装置、夹持装置均省略):

(1)图甲中仪器 B 的名称为
球形冷凝管
,作用为 冷凝回流,提高反应物利用率
。(2)图甲中 A 加热温度过高、浓硫酸的浓度过大,均会使 C 中收集到的粗产品呈橙色,原因是 A 中发生了副反应生成了
Br₂
;F 连接导管通入稀 NaOH 溶液中,其目的主要是吸收 SO₂、Br₂、HBr
等尾气防止污染空气。Ⅱ.溴乙烷性质的探究
用如图所示实验装置验证溴乙烷的性质:

(3)在乙中试管内加入 10 mL 6 mol·L⁻¹ NaOH 溶液和 2 mL 溴乙烷,振荡、静置,液体分层,水浴加热。该过程中反应的化学方程式为
CH₃CH₂Br+NaOH$\xrightarrow[△]{H_2O}$CH₃CH₂OH+NaBr
。(4)若将乙中试管里的 NaOH 溶液换成 NaOH 的乙醇溶液,为证明产物为乙烯,将生成的气体通入图丙所示装置。a 试管中水的作用是
吸收乙醇
;若无 a 试管,将生成的气体直接通入 b 试管中,则 b 中的试剂可以为 溴水(或Br₂的CCl₄溶液)
。
答案:
6.答案
(1)球形冷凝管 冷凝回流,提高反应物利用率
(2)Br₂ SO₂、Br₂、HBr
(3)CH₃CH₂Br+NaOH$\xrightarrow[△]{H_2O}$CH₃CH₂OH+NaBr
(4)吸收乙醇 溴水(或Br₂的CCl₄溶液)
解析
(1)图甲中利用浓硫酸与溴化钠反应生成的HBr与乙醇作用制取溴乙烷,由于乙醇易挥发,为减少损失,需对蒸气进行冷凝回流,仪器B的名称是球形冷凝管,其作用为冷凝回流,提高反应物利用率。
(2)粗产品呈橙色,表明粗产品中混有Br₂,则说明Br⁻被浓硫酸氧化,即A中发生副反应生成了Br₂;浓硫酸被Br⁻还原,生成SO₂,F连接导管通入稀NaOH溶液中,其目的主要是吸收SO₂、Br₂、HBr等尾气,防止污染空气。
(3)在乙中试管内加入10mL6mol·L⁻¹NaOH溶液和2mL溴乙烷,水浴加热,溴乙烷发生水解反应生成乙醇,反应的化学方程式为CH₃CH₂Br+NaOH$\xrightarrow[△]{H_2O}$CH₃CH₂OH+NaBr。
(1)球形冷凝管 冷凝回流,提高反应物利用率
(2)Br₂ SO₂、Br₂、HBr
(3)CH₃CH₂Br+NaOH$\xrightarrow[△]{H_2O}$CH₃CH₂OH+NaBr
(4)吸收乙醇 溴水(或Br₂的CCl₄溶液)
解析
(1)图甲中利用浓硫酸与溴化钠反应生成的HBr与乙醇作用制取溴乙烷,由于乙醇易挥发,为减少损失,需对蒸气进行冷凝回流,仪器B的名称是球形冷凝管,其作用为冷凝回流,提高反应物利用率。
(2)粗产品呈橙色,表明粗产品中混有Br₂,则说明Br⁻被浓硫酸氧化,即A中发生副反应生成了Br₂;浓硫酸被Br⁻还原,生成SO₂,F连接导管通入稀NaOH溶液中,其目的主要是吸收SO₂、Br₂、HBr等尾气,防止污染空气。
(3)在乙中试管内加入10mL6mol·L⁻¹NaOH溶液和2mL溴乙烷,水浴加热,溴乙烷发生水解反应生成乙醇,反应的化学方程式为CH₃CH₂Br+NaOH$\xrightarrow[△]{H_2O}$CH₃CH₂OH+NaBr。
查看更多完整答案,请扫码查看


