2025年练就优等生课后提分攻略九年级化学全一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年练就优等生课后提分攻略九年级化学全一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第92页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
海水晒盐工业流程中,得到的粗盐中含有泥沙等难溶性杂质和$CaCl_{2}$、$MgCl_{2}$等可溶性杂质。课外小组的同学想从粗盐中获取比较纯净的氯化钠,据此总结归纳混合物分离和提纯的一般思路和方法。
实验一:粗盐初步提纯
(1)思路分析:
①寻找性质差异点:粗盐的主要成分氯化钠易溶于水,杂质成分泥沙
②选择分离和提纯的核心方法:依据使要分离的物质与其他物质处于不同的状态,采用
(2)实验操作:
①去除粗盐中难溶性杂质的主要操作如图11-83-1所示。正确操作顺序是
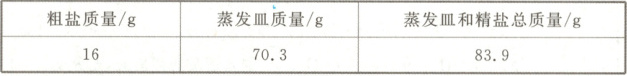
②操作Ⅱ中玻璃棒的作用是
③下列说法不正确的有
A. 操作Ⅰ利用了氯化钠易溶于水的性质
B. 操作Ⅲ得到的滤液为纯净物
C. 滤液仍浑浊,可能是液面高于滤纸边缘
D. 操作Ⅱ中应等蒸发皿中的水分全部蒸干再停止加热
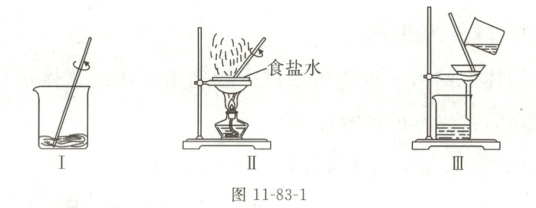
(3)误差分析:实验结束后,得到的数据如下。
①计算精盐的产率为
②若结果偏低,可能的原因有
A. 过滤时滤纸有破损
B. 蒸发时没有用玻璃棒搅拌
C. 蒸发后所得精盐很潮湿
D. 溶解时加入的水量不足
实验二:提纯氯化钠
(4)除去$NaCl$中含有的$CaCl_{2}$、$MgCl_{2}$等可溶性杂质。
①为除去$CaCl_{2}$可加入过量的
②为除去$MgCl_{2}$可加入过量的
③选择
④为了除去两种新引入的离子,可加入适量
⑤利用蒸发操作将水变为气态,与固态氯化钠分离,从而得到较纯净的氯化钠。
反思:上述操作中,步骤①和②顺序可以颠倒,但③和④顺序不能颠倒,理由是
实验一:粗盐初步提纯
(1)思路分析:
①寻找性质差异点:粗盐的主要成分氯化钠易溶于水,杂质成分泥沙
难
溶于水,二者在溶解
性上差异较大。②选择分离和提纯的核心方法:依据使要分离的物质与其他物质处于不同的状态,采用
溶解
操作将氯化钠变为溶液(液体),泥沙依然是固体,再选择过滤
操作将固体泥沙和氯化钠溶液分离,最后再利用蒸发
操作将氯化钠溶液中的水变为气体,与固体氯化钠分离。(2)实验操作:
①去除粗盐中难溶性杂质的主要操作如图11-83-1所示。正确操作顺序是
Ⅰ、Ⅲ、Ⅱ
(填序号)。
②操作Ⅱ中玻璃棒的作用是
搅拌,防止局部温度过高,造成液滴飞溅
。③下列说法不正确的有
BD
(填字母)。A. 操作Ⅰ利用了氯化钠易溶于水的性质
B. 操作Ⅲ得到的滤液为纯净物
C. 滤液仍浑浊,可能是液面高于滤纸边缘
D. 操作Ⅱ中应等蒸发皿中的水分全部蒸干再停止加热
(3)误差分析:实验结束后,得到的数据如下。
①计算精盐的产率为
85%
。②若结果偏低,可能的原因有
BD
(填字母)。A. 过滤时滤纸有破损
B. 蒸发时没有用玻璃棒搅拌
C. 蒸发后所得精盐很潮湿
D. 溶解时加入的水量不足
实验二:提纯氯化钠
(4)除去$NaCl$中含有的$CaCl_{2}$、$MgCl_{2}$等可溶性杂质。
①为除去$CaCl_{2}$可加入过量的
$\mathrm{Na_2CO_3}$
(填化学符号,下同)溶液,将杂质离子$Ca^{2+}$转化为不溶性沉淀$\mathrm{CaCO_3}$
,同时又引入了新的杂质离子$\mathrm{CO_3^{2-}}$
。②为除去$MgCl_{2}$可加入过量的
$\mathrm{NaOH}$
溶液,将杂质离子$Mg^{2+}$转化为不溶性沉淀$\mathrm{Mg(OH)_2}$
,同时又引入了新的杂质离子$\mathrm{OH^-}$
。③选择
过滤
操作将固体沉淀从溶液中分离出去。④为了除去两种新引入的离子,可加入适量
稀盐酸
。⑤利用蒸发操作将水变为气态,与固态氯化钠分离,从而得到较纯净的氯化钠。
反思:上述操作中,步骤①和②顺序可以颠倒,但③和④顺序不能颠倒,理由是
若先加入稀盐酸,会与生成的碳酸钙和氢氧化镁两种沉淀反应,生成可溶的镁离子和钙离子,重新引入杂质(合理即可)
。
答案:
题组 083 粗盐中难溶性杂质的去除
(学生必做实验 8)
(1)①难 溶解 ②溶解 过滤 蒸发
(2)①Ⅰ、Ⅲ、Ⅱ ②搅拌,防止局部温度过高,造成液滴飞溅 ③BD
(3)①85% ②BD
(4)①$\mathrm{Na_2CO_3}$ $\mathrm{CaCO_3}$ $\mathrm{CO_3^{2-}}$ ②$\mathrm{NaOH}$ $\mathrm{Mg(OH)_2}$ $\mathrm{OH^-}$ ③过滤 ④稀盐酸
反思:若先加入稀盐酸,会与生成的碳酸钙和氢氧化镁两种沉淀反应,生成可溶的镁离子和钙离子,重新引入杂质(合理即可)
(学生必做实验 8)
(1)①难 溶解 ②溶解 过滤 蒸发
(2)①Ⅰ、Ⅲ、Ⅱ ②搅拌,防止局部温度过高,造成液滴飞溅 ③BD
(3)①85% ②BD
(4)①$\mathrm{Na_2CO_3}$ $\mathrm{CaCO_3}$ $\mathrm{CO_3^{2-}}$ ②$\mathrm{NaOH}$ $\mathrm{Mg(OH)_2}$ $\mathrm{OH^-}$ ③过滤 ④稀盐酸
反思:若先加入稀盐酸,会与生成的碳酸钙和氢氧化镁两种沉淀反应,生成可溶的镁离子和钙离子,重新引入杂质(合理即可)
查看更多完整答案,请扫码查看


