2026年金考卷中考试题汇编45套化学山东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年金考卷中考试题汇编45套化学山东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第27页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
13. 物质的检验、鉴别、除杂是化学研究的重要方法。下列实验方案能达到目的的是(
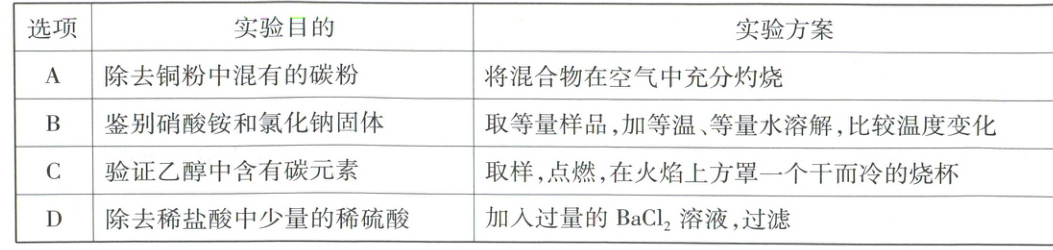
B
)
答案:
13. B
A(×)铜粉和碳粉的混合物在空气中灼烧,碳粉燃烧生成CO₂,铜会和氧气反应生成CuO,无法得到铜粉。
B(√)硝酸铵溶于水吸热,溶液温度显著降低,氯化钠溶于水温度基本不变,通过比较溶解时的温度变化可鉴别硝酸铵和氯化钠。
C(×)点燃乙醇,在火焰上方罩干冷烧杯只能检测水(验证乙醇中含有氢元素),无法验证乙醇中含有碳元素(需通过澄清石灰水检测CO₂)。
D(×)氯化钡能与稀硫酸反应:H₂SO₄ + BaCl₂ ══ BaSO₄↓ + 2HCl,加入BaCl₂溶液能除去H₂SO₄,但BaCl₂过量,会引入Ba²⁺。
A(×)铜粉和碳粉的混合物在空气中灼烧,碳粉燃烧生成CO₂,铜会和氧气反应生成CuO,无法得到铜粉。
B(√)硝酸铵溶于水吸热,溶液温度显著降低,氯化钠溶于水温度基本不变,通过比较溶解时的温度变化可鉴别硝酸铵和氯化钠。
C(×)点燃乙醇,在火焰上方罩干冷烧杯只能检测水(验证乙醇中含有氢元素),无法验证乙醇中含有碳元素(需通过澄清石灰水检测CO₂)。
D(×)氯化钡能与稀硫酸反应:H₂SO₄ + BaCl₂ ══ BaSO₄↓ + 2HCl,加入BaCl₂溶液能除去H₂SO₄,但BaCl₂过量,会引入Ba²⁺。
14. 下列图像能正确反映其对应实验操作的是(
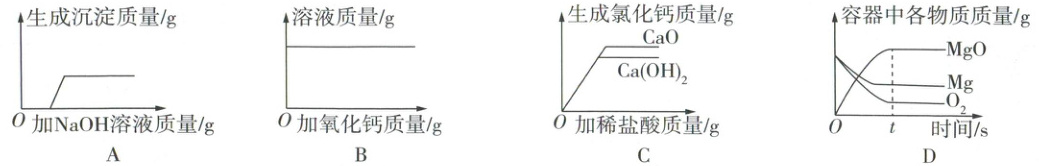
A.向一定质量的含${HCl}$和${MgCl_{2}}$的稀溶液中滴加${NaOH}$溶液至过量
B.一定温度时,向一定质量的饱和${Ca(OH)_{2}}$溶液中加入${CaO}$
C.向等质量的${CaO}$、${Ca(OH)_{2}}$中分别滴加相同溶质质量分数的稀盐酸至过量
D.将等质量的镁和氧气在密闭容器中充分燃烧
AC
)
A.向一定质量的含${HCl}$和${MgCl_{2}}$的稀溶液中滴加${NaOH}$溶液至过量
B.一定温度时,向一定质量的饱和${Ca(OH)_{2}}$溶液中加入${CaO}$
C.向等质量的${CaO}$、${Ca(OH)_{2}}$中分别滴加相同溶质质量分数的稀盐酸至过量
D.将等质量的镁和氧气在密闭容器中充分燃烧
答案:
14. AC
选项正误分析:
A √ 向一定质量的含HCl和MgCl₂的稀溶液中滴加NaOH溶液至过量,NaOH首先和稀盐酸反应生成NaCl和H₂O,稀盐酸消耗完后,NaOH再和MgCl₂反应生成Mg(OH)₂沉淀和NaCl,MgCl₂消耗完后,沉淀质量不再增加
B × 一定温度时,向一定质量的饱和Ca(OH)₂溶液中加入CaO,会发生反应:CaO + H₂O ══ Ca(OH)₂。随着CaO的不断加入,溶液中溶剂质量逐渐减小,Ca(OH)₂逐渐析出,溶剂的减少和Ca(OH)₂析出会导致溶液质量逐渐减小,最终溶液质量为0
C √ 向等质量的CaO、Ca(OH)₂中分别滴加相同溶质质量分数的稀盐酸至过量,发生反应:CaO + 2HCl ══ CaCl₂ + H₂O、Ca(OH)₂ + 2HCl ══ CaCl₂ + 2H₂O,由化学方程式可知,2HCl ~ CaCl₂,即CaO、Ca(OH)₂足量时,等质量的稀盐酸产生CaCl₂的质量相同;由化学方程式可知,CaO和HCl反应的质量比为56:73,Ca(OH)₂和HCl反应的质量比为74:73,即等质量的CaO、Ca(OH)₂中分别滴加足量相同溶质质量分数的稀盐酸时,CaO消耗的稀盐酸质量大,则CaO反应生成CaCl₂的质量大
D × 将等质量的镁和氧气在密闭容器中充分燃烧,由化学方程式$2Mg + O₂ \stackrel{点燃}{=\!=\!=} 2MgO$可知,参加反应的镁、氧气的质量比为48:32,消耗的镁的质量大于氧气的质量,则反应结束后,剩余镁的质量小于氧气的质量
B、D的正确图像是:


名师敲重点:归纳总结初中化学中的优先反应
当金属与盐溶液反应时,较活泼的金属优先置换出最不活泼的金属;若某一溶液中同时含有多种金属离子,则加入一种金属时,优先置换出金属活动性最弱的金属的离子;若某一溶液中只含有一种金属离子,则加入多种金属单质时,活动性最强的金属优先发生置换反应。
酸与碱的反应一般优先于该酸与盐的反应;如将稀盐酸逐滴滴加到NaOH和Na₂CO₃的混合溶液中,先发生反应HCl + NaOH ══ NaCl + H₂O,此反应无明显现象;待NaOH被完全消耗,再发生反应2HCl + Na₂CO₃ ══ 2NaCl + H₂O + CO₂↑,此反应有气泡产生。
14. AC
选项正误分析:
A √ 向一定质量的含HCl和MgCl₂的稀溶液中滴加NaOH溶液至过量,NaOH首先和稀盐酸反应生成NaCl和H₂O,稀盐酸消耗完后,NaOH再和MgCl₂反应生成Mg(OH)₂沉淀和NaCl,MgCl₂消耗完后,沉淀质量不再增加
B × 一定温度时,向一定质量的饱和Ca(OH)₂溶液中加入CaO,会发生反应:CaO + H₂O ══ Ca(OH)₂。随着CaO的不断加入,溶液中溶剂质量逐渐减小,Ca(OH)₂逐渐析出,溶剂的减少和Ca(OH)₂析出会导致溶液质量逐渐减小,最终溶液质量为0
C √ 向等质量的CaO、Ca(OH)₂中分别滴加相同溶质质量分数的稀盐酸至过量,发生反应:CaO + 2HCl ══ CaCl₂ + H₂O、Ca(OH)₂ + 2HCl ══ CaCl₂ + 2H₂O,由化学方程式可知,2HCl ~ CaCl₂,即CaO、Ca(OH)₂足量时,等质量的稀盐酸产生CaCl₂的质量相同;由化学方程式可知,CaO和HCl反应的质量比为56:73,Ca(OH)₂和HCl反应的质量比为74:73,即等质量的CaO、Ca(OH)₂中分别滴加足量相同溶质质量分数的稀盐酸时,CaO消耗的稀盐酸质量大,则CaO反应生成CaCl₂的质量大
D × 将等质量的镁和氧气在密闭容器中充分燃烧,由化学方程式$2Mg + O₂ \stackrel{点燃}{=\!=\!=} 2MgO$可知,参加反应的镁、氧气的质量比为48:32,消耗的镁的质量大于氧气的质量,则反应结束后,剩余镁的质量小于氧气的质量
B、D的正确图像是:


名师敲重点:归纳总结初中化学中的优先反应
当金属与盐溶液反应时,较活泼的金属优先置换出最不活泼的金属;若某一溶液中同时含有多种金属离子,则加入一种金属时,优先置换出金属活动性最弱的金属的离子;若某一溶液中只含有一种金属离子,则加入多种金属单质时,活动性最强的金属优先发生置换反应。
酸与碱的反应一般优先于该酸与盐的反应;如将稀盐酸逐滴滴加到NaOH和Na₂CO₃的混合溶液中,先发生反应HCl + NaOH ══ NaCl + H₂O,此反应无明显现象;待NaOH被完全消耗,再发生反应2HCl + Na₂CO₃ ══ 2NaCl + H₂O + CO₂↑,此反应有气泡产生。
15. 将$m\ {g}$碳酸钙固体高温加热一段时间后,冷却,测得剩余固体的质量是$15.6\ {g}$,且剩余固体中钙元素与碳元素的质量比是$20:3$。下列有关说法正确的是(
A.$m$的数值是$27.9$
B.剩余固体中钙元素的质量分数是$40\%$
C.过程中产生${CO_{2}}$的质量是$4.4\ {g}$
D.剩余固体中碳酸钙与氧化钙的质量比是$25:14$
CD
)A.$m$的数值是$27.9$
B.剩余固体中钙元素的质量分数是$40\%$
C.过程中产生${CO_{2}}$的质量是$4.4\ {g}$
D.剩余固体中碳酸钙与氧化钙的质量比是$25:14$
答案:
15. CD 碳酸钙高温分解生成氧化钙和二氧化碳,化学方程式为$CaCO₃ \stackrel{高温}{=\!=\!=} CaO + CO₂↑。$氧化钙中无碳元素,剩余固体中含有碳元素,说明剩余固体为碳酸钙和氧化钙的混合物。碳酸钙的分解过程中,钙元素的质量不变,碳酸钙中钙元素与碳元素的质量比为40:12 = 10:3,剩余固体中钙元素与碳元素的质量比为20:3,则说明已分解的碳酸钙占原碳酸钙质量的50%。则生成的氧化钙的质量是15.6g - 0.5m g。
设生成二氧化碳的质量为x,则:
$CaCO₃ \stackrel{高温}{=\!=\!=} CaO + CO₂↑$
100 56 44
0.5m g 15.6 g - 0.5m g x
$\frac{100}{44} = \frac{0.5m g}{x}$
m = 20,A错误。
$\frac{100}{56} = \frac{0.5m g}{15.6 g - 0.5m g}$
m = 20,A错误。
剩余固体中钙元素的质量为$20 g × (\frac{40}{100} × 100%) = 8 g,$剩余固体中钙元素的质量分数是$\frac{8 g}{15.6 g} × 100% ≈ 51.3%,$B错误。
剩余固体中碳酸钙与氧化钙的质量比是10 g : (15.6 g - 10 g) = 25 : 14,D正确。
设生成二氧化碳的质量为x,则:
$CaCO₃ \stackrel{高温}{=\!=\!=} CaO + CO₂↑$
100 56 44
0.5m g 15.6 g - 0.5m g x
$\frac{100}{44} = \frac{0.5m g}{x}$
m = 20,A错误。
$\frac{100}{56} = \frac{0.5m g}{15.6 g - 0.5m g}$
m = 20,A错误。
剩余固体中钙元素的质量为$20 g × (\frac{40}{100} × 100%) = 8 g,$剩余固体中钙元素的质量分数是$\frac{8 g}{15.6 g} × 100% ≈ 51.3%,$B错误。
剩余固体中碳酸钙与氧化钙的质量比是10 g : (15.6 g - 10 g) = 25 : 14,D正确。
16. 国家非物质文化遗产“章丘铁锅”表面光滑如镜,炒菜不粘锅。制作时经过了冷锻、热锻等十二道工序,上万次捶打。兴趣小组以“章丘铁锅”为主题进行项目式学习。

任务一:认识铁料的来源
(1)自然界中的铁。因为铁的化学性质
(2)炼铁。工业炼铁常用热还原法。一氧化碳在高温条件下还原氧化铁的化学方程式是
任务二:认识铁锅的制作
(3)裁料。在钢板上划线,沿线切出锅胚。传统工艺常用一种蓝色溶液划线,划线处会出现红色物质,该蓝色溶液可能是
(4)锻打。铁锅胚锻打成型,是利用铁具有
(5)淬火。将锻打好的铁锅加热,然后伸入到冷水中,铁在高温下与水蒸气反应生成一层致密的四氧化三铁,铁锅的硬度和耐磨性会显著增强,另外还生成一种气体单质。该反应的化学方程式是
(6)防锈。在制好的铁锅表面涂一层油防止锈蚀,其原理是

任务一:认识铁料的来源
(1)自然界中的铁。因为铁的化学性质
比较活泼
,所以自然界中的铁元素大多以化合物
形式存在。(2)炼铁。工业炼铁常用热还原法。一氧化碳在高温条件下还原氧化铁的化学方程式是
$Fe₂O₃ + 3CO \stackrel{高温}{=\!=\!=} 2Fe + 3CO₂$
。任务二:认识铁锅的制作
(3)裁料。在钢板上划线,沿线切出锅胚。传统工艺常用一种蓝色溶液划线,划线处会出现红色物质,该蓝色溶液可能是
硫酸铜(合理即可)
(写一种物质)溶液。(4)锻打。铁锅胚锻打成型,是利用铁具有
延展性
(性质)。(5)淬火。将锻打好的铁锅加热,然后伸入到冷水中,铁在高温下与水蒸气反应生成一层致密的四氧化三铁,铁锅的硬度和耐磨性会显著增强,另外还生成一种气体单质。该反应的化学方程式是
$3Fe + 4H₂O(g) \stackrel{高温}{=\!=\!=} Fe₃O₄ + 4H₂$
。(6)防锈。在制好的铁锅表面涂一层油防止锈蚀,其原理是
隔绝氧气和水
。
答案:
16.
(1)比较活泼 化合物$ (2)Fe₂O₃ + 3CO \stackrel{高温}{=\!=\!=} 2Fe + 3CO₂ (3)$硫酸铜(合理即可)
(4)延展性$ (5)3Fe + 4H₂O(g) \stackrel{高温}{=\!=\!=} Fe₃O₄ + 4H₂ (6)$隔绝氧气和水
(1)比较活泼 化合物$ (2)Fe₂O₃ + 3CO \stackrel{高温}{=\!=\!=} 2Fe + 3CO₂ (3)$硫酸铜(合理即可)
(4)延展性$ (5)3Fe + 4H₂O(g) \stackrel{高温}{=\!=\!=} Fe₃O₄ + 4H₂ (6)$隔绝氧气和水
查看更多完整答案,请扫码查看


