2026年金考卷中考试题汇编45套化学山东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年金考卷中考试题汇编45套化学山东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第111页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
20. 新考法 压强原理在化学实验中的应用 (10分)压强原理在化学实验中有广泛应用,下图所示三个实验均应用了压强原理,请回答下列问题:
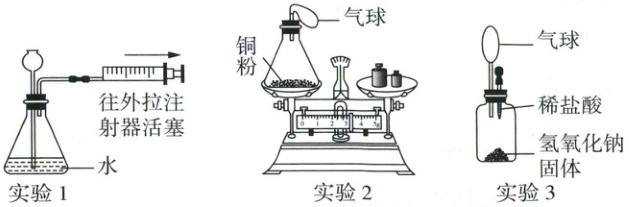
(1)实验1:按图操作,观察到
(2)实验2:取下锥形瓶隔着陶土网加热时,观察到气球先膨胀,后变小,最终气球变得比加热前更瘪。气球变得更瘪的原因是
(3)实验3:挤入稀盐酸后,观察到气球膨胀,该现象能否证明盐酸能与氢氧化钠反应? 并说明理由:
(4)实验中引起压强变化的因素有:①体系内气体的量变化;②体系的温度变化;③体系的容积变化。实验2加热时引起体系内压强变化的因素有

(1)实验1:按图操作,观察到
长颈漏斗下端有气泡冒出
,说明装置气密性良好。(2)实验2:取下锥形瓶隔着陶土网加热时,观察到气球先膨胀,后变小,最终气球变得比加热前更瘪。气球变得更瘪的原因是
加热时铜粉消耗了锥形瓶内的氧气,使瓶内压强变小
,实验中能证明铜与氧气反应遵守质量守恒定律的现象为反应前后装置及装置中试剂的总质量不变
。(3)实验3:挤入稀盐酸后,观察到气球膨胀,该现象能否证明盐酸能与氢氧化钠反应? 并说明理由:
不能,氢氧化钠固体溶于水放出热量也会使气球膨胀
。(4)实验中引起压强变化的因素有:①体系内气体的量变化;②体系的温度变化;③体系的容积变化。实验2加热时引起体系内压强变化的因素有
①②
(填标号)。
答案:
20
(1)长颈漏斗下端有气泡冒出
(2)加热时铜粉消耗了锥形瓶内的氧气,使瓶内压强变小 反应前后装置及装置中试剂的总质量不变
(3)不能,氢氧化钠固体溶于水放出热量也会使气球膨胀
(4)①②
[解题思路]
(1)装置气密性良好,将注射器活塞往外拉,增大了体系的容积,装置内压强变小,在大气压作用下,外界空气进入锥形瓶中,可观察到长颈漏斗下端有气泡冒出。
(2)影响锥形瓶内压强的因素:一是温度变化,二是瓶内气体的量的变化。刚开始加热时,温度变化是主要因素,气体的量的变化是次要因素,温度升高,瓶内压强增大,故观察到气球膨胀;随着反应的进行,铜粉不断消耗瓶内O₂,最终,瓶内温度恢复至室温,瓶内气体变少,因此瓶内压强变小,气球变得比加热前更瘪。反应前后装置及装置内试剂的总质量不变可证明铜与氧气反应遵守质量守恒定律。
(3)稀盐酸中有水,氢氧化钠固体溶于水放热,可使气球膨胀,因此气球膨胀不能证明盐酸与氢氧化钠发生了反应。
(4)实验2加热时,压强变化与体系内气体的量、温度有关,故选①②。
(1)长颈漏斗下端有气泡冒出
(2)加热时铜粉消耗了锥形瓶内的氧气,使瓶内压强变小 反应前后装置及装置中试剂的总质量不变
(3)不能,氢氧化钠固体溶于水放出热量也会使气球膨胀
(4)①②
[解题思路]
(1)装置气密性良好,将注射器活塞往外拉,增大了体系的容积,装置内压强变小,在大气压作用下,外界空气进入锥形瓶中,可观察到长颈漏斗下端有气泡冒出。
(2)影响锥形瓶内压强的因素:一是温度变化,二是瓶内气体的量的变化。刚开始加热时,温度变化是主要因素,气体的量的变化是次要因素,温度升高,瓶内压强增大,故观察到气球膨胀;随着反应的进行,铜粉不断消耗瓶内O₂,最终,瓶内温度恢复至室温,瓶内气体变少,因此瓶内压强变小,气球变得比加热前更瘪。反应前后装置及装置内试剂的总质量不变可证明铜与氧气反应遵守质量守恒定律。
(3)稀盐酸中有水,氢氧化钠固体溶于水放热,可使气球膨胀,因此气球膨胀不能证明盐酸与氢氧化钠发生了反应。
(4)实验2加热时,压强变化与体系内气体的量、温度有关,故选①②。
21. (16分)硫酸铜是一种广泛应用于工业生产和科学研究的化合物。化学小组同学对硫酸铜进行了项目式探究。
(1)硫酸铜的性质
【实验一】①用pH计测得硫酸铜溶液的pH为4.2,硫酸铜溶液显
②向硫酸铜溶液中滴加氢氧化钠溶液,出现蓝色絮状沉淀,反应的化学方程式为
(2)硫酸铜的用途
农业上可用
(3)硫酸铜的制备
【实验二】先用砂纸将铜丝打磨光亮,再将铜丝绕成螺旋状并插入过氧化氢和稀硫酸的混合溶液中,观察到开始时有少量气泡产生,后来反应剧烈并产生大量气泡,放出热量。
【提出问题1】产生的气体是什么?
【猜想】猜想1:可能是氢气;猜想2:可能是氧气。
【设计与实验1】

【讨论】实验后,小组同学认为方案①存在安全隐患,其原因是
【提出问题2】产生气体的原因是什么?
【猜想】猜想3:可能是CuSO₄促进过氧化氢分解;猜想4:可能是温度升高加快过氧化氢分解;猜想5:可能是CuSO₄和温度升高共同影响。
【设计与实验2】
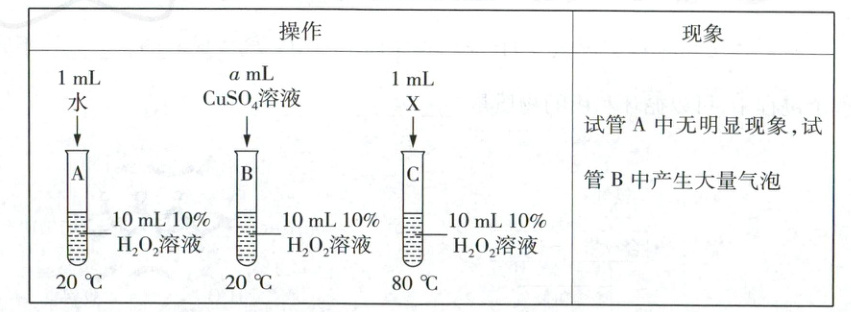
【分析】①试管B中加入CuSO₄溶液,其中a =
②对试管C中加入的物质小红和小涛有不同的方案:小红认为试管C中加入的X是水,小涛认为试管C中加入的X是CuSO₄溶液。但老师建议采用小红的方案,其原因是
(1)硫酸铜的性质
【实验一】①用pH计测得硫酸铜溶液的pH为4.2,硫酸铜溶液显
酸
性。②向硫酸铜溶液中滴加氢氧化钠溶液,出现蓝色絮状沉淀,反应的化学方程式为
2NaOH + CuSO₄ = Cu(OH)₂↓ + Na₂SO₄
。(2)硫酸铜的用途
农业上可用
石灰乳
和硫酸铜溶液配制杀菌剂波尔多液;切割钢板时,用硫酸铜溶液在钢板上画出红线,其原理是铁置换出硫酸铜溶液中的铜,铜为红色固体(合理即可)
。(3)硫酸铜的制备
【实验二】先用砂纸将铜丝打磨光亮,再将铜丝绕成螺旋状并插入过氧化氢和稀硫酸的混合溶液中,观察到开始时有少量气泡产生,后来反应剧烈并产生大量气泡,放出热量。
【提出问题1】产生的气体是什么?
【猜想】猜想1:可能是氢气;猜想2:可能是氧气。
【设计与实验1】

【讨论】实验后,小组同学认为方案①存在安全隐患,其原因是
氢气具有可燃性,氢气与空气的混合物遇明火可能会发生爆炸
。【提出问题2】产生气体的原因是什么?
【猜想】猜想3:可能是CuSO₄促进过氧化氢分解;猜想4:可能是温度升高加快过氧化氢分解;猜想5:可能是CuSO₄和温度升高共同影响。
【设计与实验2】

【分析】①试管B中加入CuSO₄溶液,其中a =
1
。②对试管C中加入的物质小红和小涛有不同的方案:小红认为试管C中加入的X是水,小涛认为试管C中加入的X是CuSO₄溶液。但老师建议采用小红的方案,其原因是
小红方案中可避免硫酸铜的干扰(或小涛的方案可能导致反应过于剧烈,有安全隐患等)
。
答案:
21
(1)①酸 ②2NaOH + CuSO₄ = Cu(OH)₂↓ + Na₂SO₄
(2)石灰乳 铁置换出硫酸铜溶液中的铜,铜为红色固体(合理即可)
(3)【设计与实验1】带火星的木条复燃 【讨论】氢气具有可燃性,氢气与空气的混合物遇明火可能会发生爆炸 【分析】①1 ②小红方案中可避免硫酸铜的干扰(或小涛的方案可能导致反应过于剧烈,有安全隐患等)
[解题思路]
(1)①pH小于7的溶液显酸性,硫酸铜溶液的pH为4.2,小于7,显酸性。②硫酸铜溶液与氢氧化钠溶液反应生成氢氧化钙沉淀和硫酸钠,反应的化学方程式为2NaOH + CuSO₄ = Cu(OH)₂↓ + Na₂SO₄。
(2)农业上常用石灰乳和硫酸铜溶液混合配制波尔多液;Fe的金属活动性强于Cu,能从CuSO₄溶液中置换出Cu(显红色),故用CuSO₄溶液在钢板上画线时,钢中的Fe与CuSO₄溶液反应,置换出Cu,在钢板表面形成红线。
(3)【设计与实验1】氧气具有助燃性,可使带火星的木条复燃。操作①的结论是猜想2正确,即产生气体是O₂,故可观察到带火星的木条复燃。【讨论】H₂是可燃性气体,方案①中将带火星的木条伸入试管中,如果产生的气体为H₂,由于试管中另有空气,H₂与空气的混合气体遇明火可能发生爆炸,存在安全隐患。【分析】①根据控制变量思想,加入CuSO₄溶液的体积应该是1mL。②对比试管A、B中的现象可知CuSO₄能加快过氧化氢的分解;按小红的方案,试管C加入水,则试管A、C对比可探究温度对过氧化氢分解的影响;按小涛的方案,试管C中加入CuSO₄溶液,则实验对照组中影响过氧化氢分解的因素除了温度还有CuSO₄,CuSO₄能加快过氧化氢的分解,温度也能加快过氧化氢分解,可能会导致反应过于剧烈,产生安全隐患,故应选择小红的方案。
(1)①酸 ②2NaOH + CuSO₄ = Cu(OH)₂↓ + Na₂SO₄
(2)石灰乳 铁置换出硫酸铜溶液中的铜,铜为红色固体(合理即可)
(3)【设计与实验1】带火星的木条复燃 【讨论】氢气具有可燃性,氢气与空气的混合物遇明火可能会发生爆炸 【分析】①1 ②小红方案中可避免硫酸铜的干扰(或小涛的方案可能导致反应过于剧烈,有安全隐患等)
[解题思路]
(1)①pH小于7的溶液显酸性,硫酸铜溶液的pH为4.2,小于7,显酸性。②硫酸铜溶液与氢氧化钠溶液反应生成氢氧化钙沉淀和硫酸钠,反应的化学方程式为2NaOH + CuSO₄ = Cu(OH)₂↓ + Na₂SO₄。
(2)农业上常用石灰乳和硫酸铜溶液混合配制波尔多液;Fe的金属活动性强于Cu,能从CuSO₄溶液中置换出Cu(显红色),故用CuSO₄溶液在钢板上画线时,钢中的Fe与CuSO₄溶液反应,置换出Cu,在钢板表面形成红线。
(3)【设计与实验1】氧气具有助燃性,可使带火星的木条复燃。操作①的结论是猜想2正确,即产生气体是O₂,故可观察到带火星的木条复燃。【讨论】H₂是可燃性气体,方案①中将带火星的木条伸入试管中,如果产生的气体为H₂,由于试管中另有空气,H₂与空气的混合气体遇明火可能发生爆炸,存在安全隐患。【分析】①根据控制变量思想,加入CuSO₄溶液的体积应该是1mL。②对比试管A、B中的现象可知CuSO₄能加快过氧化氢的分解;按小红的方案,试管C加入水,则试管A、C对比可探究温度对过氧化氢分解的影响;按小涛的方案,试管C中加入CuSO₄溶液,则实验对照组中影响过氧化氢分解的因素除了温度还有CuSO₄,CuSO₄能加快过氧化氢的分解,温度也能加快过氧化氢分解,可能会导致反应过于剧烈,产生安全隐患,故应选择小红的方案。
查看更多完整答案,请扫码查看


