2026年金考卷中考试题汇编45套化学山东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年金考卷中考试题汇编45套化学山东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第119页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
20. 新考法 化学反应的调控 (11分)化学反应需要一定的条件,控制条件可以调控化学反应。
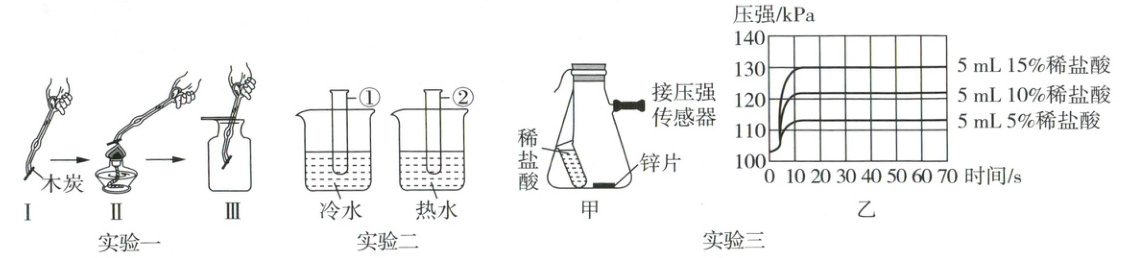
(1)实验一:木炭在氧气中燃烧的实验,比较步骤Ⅱ和Ⅲ木炭燃烧的情况,得出影响燃烧的因素是
(2)实验二:试管①和②中各加入4%的$H_{2}O_{2}$溶液5mL,分别将试管放在冷水和热水中,观察到试管②中产生大量气泡,反应的化学方程式为
(3)实验三:如图甲所示,选用相同的锌片与不同质量分数的稀盐酸反应,用压强传感器测量装置内的压强变化,结果如图乙。该实验中,反应速率最快的稀盐酸的质量分数是
(4)以上三个实验中,影响化学反应速率的因素相同的是实验
【实际应用】鲜牛奶冷藏于冰箱比置于室温中能保存更久,请说明其是如何通过控制“反应条件”调控化学反应的:

(1)实验一:木炭在氧气中燃烧的实验,比较步骤Ⅱ和Ⅲ木炭燃烧的情况,得出影响燃烧的因素是
氧气的浓度
;使木炭熄灭,可采用的方法是将木炭插入水中(合理即可)
。(2)实验二:试管①和②中各加入4%的$H_{2}O_{2}$溶液5mL,分别将试管放在冷水和热水中,观察到试管②中产生大量气泡,反应的化学方程式为
2H₂O₂ =△2H₂O + O₂↑
。(3)实验三:如图甲所示,选用相同的锌片与不同质量分数的稀盐酸反应,用压强传感器测量装置内的压强变化,结果如图乙。该实验中,反应速率最快的稀盐酸的质量分数是
15%
。(4)以上三个实验中,影响化学反应速率的因素相同的是实验
一、三
。【实际应用】鲜牛奶冷藏于冰箱比置于室温中能保存更久,请说明其是如何通过控制“反应条件”调控化学反应的:
通过降低温度来控制牛奶变质的速度
。
答案:
20
(1)氧气的浓度 将木炭插入水中(合理即可)
(2)2H₂O₂ =△2H₂O + O₂↑
(3)15%
(4)一、三
【实际应用】通过降低温度来控制牛奶变质的速度
【解题思路】
(1)步骤Ⅱ在空气中木炭红热,步骤Ⅲ在氧气中木炭燃烧,说明O₂浓度增大,木炭与氧气的反应更剧烈,影响反应的因素是O₂浓度。
(4)实验一、三均可说明反应物浓度影响化学反应速率,实验二可说明温度影响化学反应速率。
(1)氧气的浓度 将木炭插入水中(合理即可)
(2)2H₂O₂ =△2H₂O + O₂↑
(3)15%
(4)一、三
【实际应用】通过降低温度来控制牛奶变质的速度
【解题思路】
(1)步骤Ⅱ在空气中木炭红热,步骤Ⅲ在氧气中木炭燃烧,说明O₂浓度增大,木炭与氧气的反应更剧烈,影响反应的因素是O₂浓度。
(4)实验一、三均可说明反应物浓度影响化学反应速率,实验二可说明温度影响化学反应速率。
21. (18分)干燥剂在生产生活及科学实验中有广泛的用途。兴趣小组开展有关干燥剂的探究。
主题一:比较不同干燥剂的干燥性能
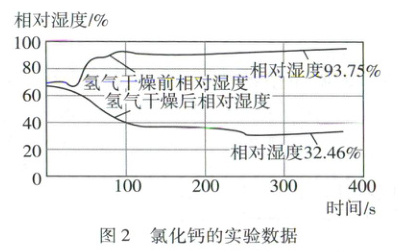
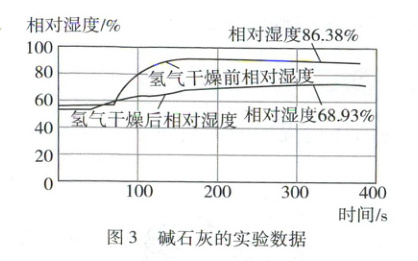
利用锌与稀硫酸反应制取氢气,连接装置(如图1)。在相同条件下分别将氯化钙、碱石灰(生石灰与氢氧化钠固体的混合物)放入U形管作干燥剂,进行实验,实验结果如图2、图3(已知:相对湿度越大,则气体湿度越大)。
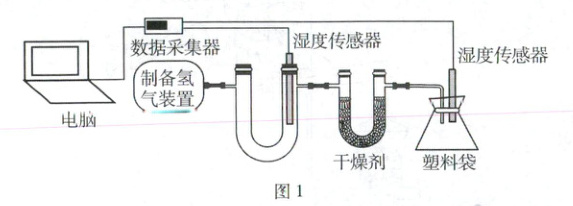
(1)比较两种干燥剂的干燥效果需要控制相同的条件,如控制干燥剂的
(2)根据图2和图3,选出干燥效果更好的干燥剂并说明理由:
主题二:探究久置干燥剂的再利用
(3)检验久置生石灰的成分
【作出猜想】久置生石灰的成分可能是:
猜想1:CaO 猜想2:$Ca(OH)_{2}$ 猜想3:$CaCO_{3}$ 猜想4:CaO、$Ca(OH)_{2}$、$CaCO_{3}$中的两种或三种
【查找资料】氢氧化钙、碳酸钙固体受热会分解,生成物都是氧化物。
【进行实验】甲、乙、丙三位同学分别取久置生石灰样品进行如下实验。
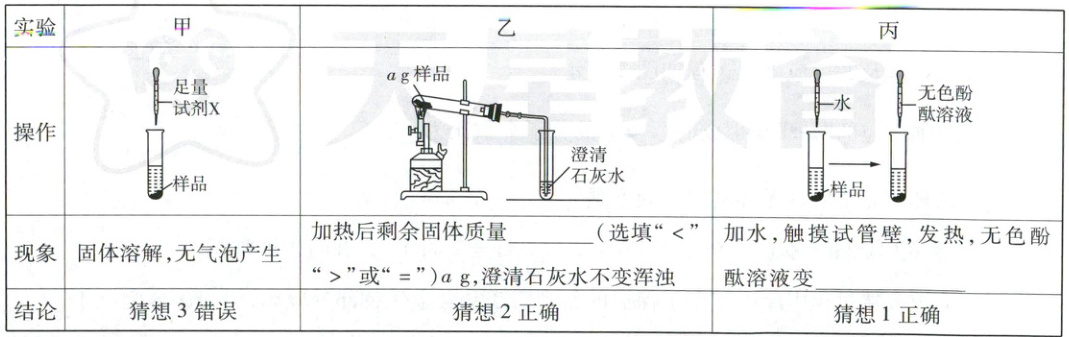
试剂X为
【讨论交流】同学们经过讨论后认为乙、丙同学的结论不严谨,选择其中一个说明理由:
【得出结论】综合甲、乙、丙同学实验可知该久置生石灰的成分是
【实验拓展】丁同学认为只进行实验乙,若澄清石灰水不变浑浊,称量ag样品充分反应,剩余固体的质量记为mg,m与a关系为
(4)用久置生石灰干燥剂制备氯化钙干燥剂
现欲用上述久置生石灰干燥剂制备氯化钙干燥剂,写出简要的制备方案:
主题一:比较不同干燥剂的干燥性能
利用锌与稀硫酸反应制取氢气,连接装置(如图1)。在相同条件下分别将氯化钙、碱石灰(生石灰与氢氧化钠固体的混合物)放入U形管作干燥剂,进行实验,实验结果如图2、图3(已知:相对湿度越大,则气体湿度越大)。

(1)比较两种干燥剂的干燥效果需要控制相同的条件,如控制干燥剂的
质量、颗粒大小
相同(写出两种)。(2)根据图2和图3,选出干燥效果更好的干燥剂并说明理由:
氯化钙,理由是氢气相对湿度变化值经氯化钙干燥后减小约61%,而经碱石灰干燥后减小约17%
。主题二:探究久置干燥剂的再利用
(3)检验久置生石灰的成分
【作出猜想】久置生石灰的成分可能是:
猜想1:CaO 猜想2:$Ca(OH)_{2}$ 猜想3:$CaCO_{3}$ 猜想4:CaO、$Ca(OH)_{2}$、$CaCO_{3}$中的两种或三种
【查找资料】氢氧化钙、碳酸钙固体受热会分解,生成物都是氧化物。
【进行实验】甲、乙、丙三位同学分别取久置生石灰样品进行如下实验。

试剂X为
稀盐酸(合理即可)
。【讨论交流】同学们经过讨论后认为乙、丙同学的结论不严谨,选择其中一个说明理由:
实验乙,样品中可能含有氧化钙(或实验丙,样品中可能含有氢氧化钙)
。【得出结论】综合甲、乙、丙同学实验可知该久置生石灰的成分是
CaO、Ca(OH)₂
。【实验拓展】丁同学认为只进行实验乙,若澄清石灰水不变浑浊,称量ag样品充分反应,剩余固体的质量记为mg,m与a关系为
m>56a/74
(用m、a关系式表示)也可以得出结论。(4)用久置生石灰干燥剂制备氯化钙干燥剂
现欲用上述久置生石灰干燥剂制备氯化钙干燥剂,写出简要的制备方案:
往久置的生石灰干燥剂中加入过量的稀盐酸,充分反应后蒸发、结晶
。

答案:
21
(1)质量、颗粒大小
(2)氯化钙,理由是氢气相对湿度变化值经氯化钙干燥后减小约61%,而经碱石灰干燥后减小约17%
(3)[进行实验]< 红 稀盐酸(合理即可) [讨论交流]实验乙,样品中可能含有氧化钙(或实验丙,样品中可能含有氢氧化钙) [实验结论]CaO、Ca(OH)₂ [实验拓展]m>56a/74
(4)往久置的生石灰干燥剂中加入过量的稀盐酸,充分反应后蒸发、结晶
【解题思路】
(1)用控制变量法对比干燥效果,除干燥剂种类不同外,其他条件均要保持相同,如质量、颗粒大小、温度等。
(3)[进行实验]实验乙:猜想2正确,说明样品中含Ca(OH)₂,即加热样品后固体质量减小。
实验丙:猜想1正确,说明样品中含有CaO,CaO与水反应生成Ca(OH)₂,并放出热量,故试管壁会发热;Ca(OH)₂溶液显碱性,能使酚酞溶液变红。
实验甲:猜想3错误,说明样品中不含CaCO₃,反应现象是固体溶解、无气泡产生,故应向样品中滴加稀盐酸或稀硫酸等。
[实验拓展]澄清石灰水不变浑浊,说明样品中不含CaCO₃。假设ag样品中只含Ca(OH)₂,反应后剩余固体的质量为x,结合氢氧化钙受热分解产物都是氧化物可得:
Ca(OH)₂ =△CaO + H₂O
74 56
ag x
74/56 = ag/x
x = 56a/74g
故若剩余固体质量大于56a/74g时,说明样品中不仅含有Ca(OH)₂,还含有CaO。
(4)往上述久置的生石灰干燥剂中加入过量的稀盐酸,发生反应:CaO + 2HCl = CaCl₂ + H₂O、Ca(OH)₂ + 2HCl = CaCl₂ + 2H₂O,充分反应后蒸发(过量的HCl挥发),结晶得到纯净的氯化钙。
(1)质量、颗粒大小
(2)氯化钙,理由是氢气相对湿度变化值经氯化钙干燥后减小约61%,而经碱石灰干燥后减小约17%
(3)[进行实验]< 红 稀盐酸(合理即可) [讨论交流]实验乙,样品中可能含有氧化钙(或实验丙,样品中可能含有氢氧化钙) [实验结论]CaO、Ca(OH)₂ [实验拓展]m>56a/74
(4)往久置的生石灰干燥剂中加入过量的稀盐酸,充分反应后蒸发、结晶
【解题思路】
(1)用控制变量法对比干燥效果,除干燥剂种类不同外,其他条件均要保持相同,如质量、颗粒大小、温度等。
(3)[进行实验]实验乙:猜想2正确,说明样品中含Ca(OH)₂,即加热样品后固体质量减小。
实验丙:猜想1正确,说明样品中含有CaO,CaO与水反应生成Ca(OH)₂,并放出热量,故试管壁会发热;Ca(OH)₂溶液显碱性,能使酚酞溶液变红。
实验甲:猜想3错误,说明样品中不含CaCO₃,反应现象是固体溶解、无气泡产生,故应向样品中滴加稀盐酸或稀硫酸等。
[实验拓展]澄清石灰水不变浑浊,说明样品中不含CaCO₃。假设ag样品中只含Ca(OH)₂,反应后剩余固体的质量为x,结合氢氧化钙受热分解产物都是氧化物可得:
Ca(OH)₂ =△CaO + H₂O
74 56
ag x
74/56 = ag/x
x = 56a/74g
故若剩余固体质量大于56a/74g时,说明样品中不仅含有Ca(OH)₂,还含有CaO。
(4)往上述久置的生石灰干燥剂中加入过量的稀盐酸,发生反应:CaO + 2HCl = CaCl₂ + H₂O、Ca(OH)₂ + 2HCl = CaCl₂ + 2H₂O,充分反应后蒸发(过量的HCl挥发),结晶得到纯净的氯化钙。
查看更多完整答案,请扫码查看


