第46页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
17. (7分)某校化学兴趣小组的同学对海盐的生产、成分以及用途等展开了探究学习。
任务一:了解海盐的生产
【查阅资料】海盐分为原盐和精制盐。海盐生产一般采用日晒法,通过纳潮扬水将海水引入盐田,经过风吹日晒使水分蒸发,变成饱和卤水,再晒,晶体析出,得到原盐。
【交流讨论】海水经过风吹日晒后水分部分蒸发,变成饱和卤水的过程中发生的改变是
任务二:探究海盐的成分
【信息检索】海盐热敷用的是原盐。原盐的主要成分是NaCl,可能含有MgCl₂、CaCl₂、Na₂SO₄等物质。
【实验准备】取少量热敷包中的海盐于烧杯中,加足量水充分溶解、过滤,留无色溶液备用。
【进行实验】为探究海盐成分,小组同学设计如下实验方案,并完成了实验。
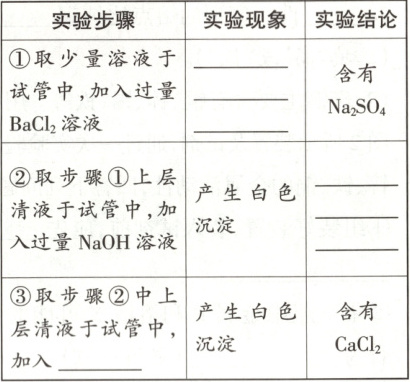
【反思评价】(1)步骤②中发生反应的化学方程式为
(2)小明认为上述步骤③得出的结论不严谨,理由是
【成果分享】同学们通过探究学习,了解到海盐的生产及成分,另外海盐还有许多重要应用,写出一条海盐的用途:
任务一:了解海盐的生产
【查阅资料】海盐分为原盐和精制盐。海盐生产一般采用日晒法,通过纳潮扬水将海水引入盐田,经过风吹日晒使水分蒸发,变成饱和卤水,再晒,晶体析出,得到原盐。
【交流讨论】海水经过风吹日晒后水分部分蒸发,变成饱和卤水的过程中发生的改变是
海水浓度增大(答案不唯一)
。任务二:探究海盐的成分
【信息检索】海盐热敷用的是原盐。原盐的主要成分是NaCl,可能含有MgCl₂、CaCl₂、Na₂SO₄等物质。
【实验准备】取少量热敷包中的海盐于烧杯中,加足量水充分溶解、过滤,留无色溶液备用。
【进行实验】为探究海盐成分,小组同学设计如下实验方案,并完成了实验。

【反思评价】(1)步骤②中发生反应的化学方程式为
MgCl₂+2NaOH=Mg(OH)₂↓+2NaCl
。(2)小明认为上述步骤③得出的结论不严谨,理由是
步骤①中过量的BaCl₂也能与Na₂CO₃反应生成白色沉淀,步骤③不能证明溶液中一定含有CaCl₂
。【成果分享】同学们通过探究学习,了解到海盐的生产及成分,另外海盐还有许多重要应用,写出一条海盐的用途:
农业选种(合理即可)
(写一条)。
答案:
17.【交流讨论】海水浓度增大(答案不唯一) 【进行实验】①产生白色沉淀 ②含有MgCl₂ ③Na₂CO₃溶液 【反思评价】
(1)MgCl₂+2NaOH=Mg(OH)₂↓+2NaCl
(2)步骤①中过量的BaCl₂也能与Na₂CO₃反应生成白色沉淀,步骤③不能证明溶液中一定含有CaCl₂ 【成果分享】农业选种(合理即可) 提示:【交流讨论】海水风吹日晒使水分蒸发变成饱和卤水,溶剂水减少,海水浓度增大,质量减小。【进行实验】①根据实验结论,海盐中含有Na₂SO₄,硫酸钠与氯化钡反应生成硫酸钡沉淀和氯化钠,故实验现象是产生白色沉淀;②取步骤①中上层清液于试管中,加入过量NaOH溶液,会产生白色沉淀,氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,说明海盐中含有MgCl₂。③取步骤②中上层清液于试管中,根据实验现象与结论可知含有CaCl₂且加入该溶液后会产生白色沉淀,则加入的是Na₂CO₃溶液。【反思评价】
(1)氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式是MgCl₂+2NaOH=Mg(OH)₂↓+2NaCl。
(2)步骤③中加入Na₂CO₃溶液,还会与步骤①加入的过量BaCl₂溶液反应生成白色沉淀BaCO₃,不能证明溶液中含有CaCl₂,因此步骤③得出的结论不严谨。【成果分享】原盐的主要成分为氯化钠,氯化钠可用于农业选种,制取碳酸钠等。
(1)MgCl₂+2NaOH=Mg(OH)₂↓+2NaCl
(2)步骤①中过量的BaCl₂也能与Na₂CO₃反应生成白色沉淀,步骤③不能证明溶液中一定含有CaCl₂ 【成果分享】农业选种(合理即可) 提示:【交流讨论】海水风吹日晒使水分蒸发变成饱和卤水,溶剂水减少,海水浓度增大,质量减小。【进行实验】①根据实验结论,海盐中含有Na₂SO₄,硫酸钠与氯化钡反应生成硫酸钡沉淀和氯化钠,故实验现象是产生白色沉淀;②取步骤①中上层清液于试管中,加入过量NaOH溶液,会产生白色沉淀,氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,说明海盐中含有MgCl₂。③取步骤②中上层清液于试管中,根据实验现象与结论可知含有CaCl₂且加入该溶液后会产生白色沉淀,则加入的是Na₂CO₃溶液。【反思评价】
(1)氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式是MgCl₂+2NaOH=Mg(OH)₂↓+2NaCl。
(2)步骤③中加入Na₂CO₃溶液,还会与步骤①加入的过量BaCl₂溶液反应生成白色沉淀BaCO₃,不能证明溶液中含有CaCl₂,因此步骤③得出的结论不严谨。【成果分享】原盐的主要成分为氯化钠,氯化钠可用于农业选种,制取碳酸钠等。
18. (5分)实验室可以通过分解过氧化氢制取氧气。向盛有少量二氧化锰的烧杯中加入136g过氧化氢溶液,充分反应后称得烧杯中物质总质量减少3.2g。请计算:
(1)实验中二氧化锰的作用是
(2)所用过氧化氢溶液的溶质质量分数。
(1)实验中二氧化锰的作用是
催化作用
。(2)所用过氧化氢溶液的溶质质量分数。
答案:
18.
(1)催化作用
(2)解:设所用过氧化氢溶液的溶质质量为x。
$2H₂O₂\overset{MnO_2}{=}2H₂O+O₂↑$
68 32
x 3.2g
$\frac{68}{32}=\frac{x}{3.2g}$
$x=\frac{68×3.2g}{32}=6.8g$
所用过氧化氢溶液的溶质质量分数为$\frac{6.8g}{136g}×100%=5%$
答:所用过氧化氢溶液的溶质质量分数为5%。
(1)催化作用
(2)解:设所用过氧化氢溶液的溶质质量为x。
$2H₂O₂\overset{MnO_2}{=}2H₂O+O₂↑$
68 32
x 3.2g
$\frac{68}{32}=\frac{x}{3.2g}$
$x=\frac{68×3.2g}{32}=6.8g$
所用过氧化氢溶液的溶质质量分数为$\frac{6.8g}{136g}×100%=5%$
答:所用过氧化氢溶液的溶质质量分数为5%。
查看更多完整答案,请扫码查看


