第41页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
3. 兴趣小组同学进行有关酸、碱、盐性质的探究,实验设计如下:
【操作步骤】
(1) 步骤 1:先检查气密性后装入镁条;
步骤 2:打开弹簧夹,向试管Ⅰ中加入一定量稀盐酸,保持导管口在液面以下。试管Ⅰ中发生反应的化学方程式是
步骤 3:关闭弹簧夹,观察到试管Ⅰ中有大量气泡产生且有许多液体流入试管Ⅱ中。

【现象分析】
(2) ① 产生上述现象的原因是
② 若试管Ⅱ中观察到溶液由红色变为无色,且无沉淀生成,此时试管Ⅰ进入试管Ⅱ中的溶液中的溶质是
【提出问题】
反应结束后,试管Ⅱ的溶液中含有哪些溶质?(酚酞除外)
【猜想与假设】
(3) 猜想 1:_;
猜想 2:HCl、NaCl、MgCl₂。
【设计并进行实验】(4)
【反思与交流】
(5) 下列物质中能替代碳酸钠的是
A. 硝酸银溶液
B. 紫色石蕊溶液
C. 金属铜
D. 氧化铁

【操作步骤】
(1) 步骤 1:先检查气密性后装入镁条;
步骤 2:打开弹簧夹,向试管Ⅰ中加入一定量稀盐酸,保持导管口在液面以下。试管Ⅰ中发生反应的化学方程式是
$Mg + 2HCl \longrightarrow MgCl_2 + H_2 \uparrow$
_。步骤 3:关闭弹簧夹,观察到试管Ⅰ中有大量气泡产生且有许多液体流入试管Ⅱ中。

【现象分析】
(2) ① 产生上述现象的原因是
镁与稀盐酸反应生成的氢气不能逸出,使得试管Ⅰ内压强增大,将
液体压入试管Ⅱ中
_。液体压入试管Ⅱ中
② 若试管Ⅱ中观察到溶液由红色变为无色,且无沉淀生成,此时试管Ⅰ进入试管Ⅱ中的溶液中的溶质是
$HCl$、$MgCl_2$
_。【提出问题】
反应结束后,试管Ⅱ的溶液中含有哪些溶质?(酚酞除外)
【猜想与假设】
(3) 猜想 1:_;
$NaCl$、$MgCl_2$
猜想 2:HCl、NaCl、MgCl₂。
【设计并进行实验】(4)
【反思与交流】
(5) 下列物质中能替代碳酸钠的是
BD
_(填选项字母)。A. 硝酸银溶液
B. 紫色石蕊溶液
C. 金属铜
D. 氧化铁

答案:
3.
(1)$Mg + 2HCl \longrightarrow MgCl_2 + H_2 \uparrow$
(2)①镁与稀盐酸反应生成的氢气不能逸出,使得试管Ⅰ内压强增大,将
液体压入试管Ⅱ中
②$HCl$、$MgCl_2$
(3)$NaCl$、$MgCl_2$
(4)有气泡产生
(5)BD
(1)$Mg + 2HCl \longrightarrow MgCl_2 + H_2 \uparrow$
(2)①镁与稀盐酸反应生成的氢气不能逸出,使得试管Ⅰ内压强增大,将
液体压入试管Ⅱ中
②$HCl$、$MgCl_2$
(3)$NaCl$、$MgCl_2$
(4)有气泡产生
(5)BD
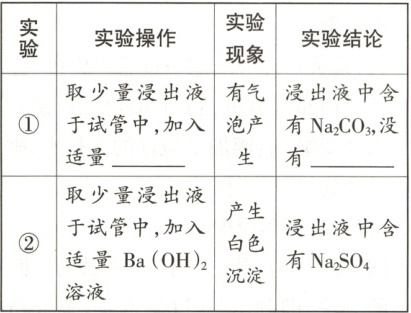
4. 黄河湿地有大片盐碱地,依据资料可知,该片盐碱地的土壤中含有的可溶性物质是 Na₂CO₃、NaCl、CaCl₂、Na₂SO₄中的一种或多种。学习小组的同学欲探究某地块的土壤中可溶性物质的成分,他们利用该地块土壤的浸出液进行了以下实验探究。
【实验探究一】
(1)
【反思评价】
(2) 讨论后,同学们一致认为通过实验②无法确定浸出液中含有 Na₂SO₄,理由是
【实验探究二】
为进一步探究浸出液的成分,同学们又进行了以下实验探究:
(3) 加入足量稀硝酸的目的是
【实验结论】
(4) 该块地的土壤中含有 Na₂CO₃、NaCl、Na₂SO₄,写出向溶液Ⅱ中加入硝酸银溶液发生反应的化学方程式:_。
【拓展应用】
(5) 下列盐碱地的改良方法中不合理的是
A. 施加有机腐殖酸
B. 施加熟石灰
C. 发展水灌排盐降碱

【实验探究一】
(1)
【反思评价】
(2) 讨论后,同学们一致认为通过实验②无法确定浸出液中含有 Na₂SO₄,理由是
浸出液中含有$Na_2CO_3$,碳酸钠与氢氧化钡反应生成碳酸钡白色沉淀,也能观察到产生白色沉淀
_。【实验探究二】
为进一步探究浸出液的成分,同学们又进行了以下实验探究:

(3) 加入足量稀硝酸的目的是
除去碳酸钠
_,已知X 是一种钡盐,根据上述实验推测,X 中的酸根离子是$NO_3^-$
_(写离子符号),白色沉淀 A 是硫酸钡。【实验结论】
(4) 该块地的土壤中含有 Na₂CO₃、NaCl、Na₂SO₄,写出向溶液Ⅱ中加入硝酸银溶液发生反应的化学方程式:_。
$AgNO_3 + NaCl \longrightarrow AgCl \downarrow + NaNO_3$
【拓展应用】
(5) 下列盐碱地的改良方法中不合理的是
B
_(填选项字母)。A. 施加有机腐殖酸
B. 施加熟石灰
C. 发展水灌排盐降碱

答案:
4.
(1)稀盐酸 $CaCl_2$
(2)浸出液中含有$Na_2CO_3$,碳酸钠与氢氧化钡反应生成碳酸钡白色沉淀,也能观察到产生白色沉淀
(3)除去碳酸钠 $NO_3^-$
(4)$AgNO_3 + NaCl \longrightarrow AgCl \downarrow + NaNO_3$
(5)B
(1)稀盐酸 $CaCl_2$
(2)浸出液中含有$Na_2CO_3$,碳酸钠与氢氧化钡反应生成碳酸钡白色沉淀,也能观察到产生白色沉淀
(3)除去碳酸钠 $NO_3^-$
(4)$AgNO_3 + NaCl \longrightarrow AgCl \downarrow + NaNO_3$
(5)B
查看更多完整答案,请扫码查看


