第30页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
1. [25·云南] KOH 的性质与 Ca(OH)₂相似。下列对 KOH 性质的预测不正确的是 (
A.能使无色酚酞溶液变红
B.能与 CO₂反应
C.能与 H₂SO₄溶液反应
D.能与 Na₂CO₃溶液反应
D
)A.能使无色酚酞溶液变红
B.能与 CO₂反应
C.能与 H₂SO₄溶液反应
D.能与 Na₂CO₃溶液反应
答案:
1.D 提示:KOH与Na₂CO₃溶液不反应,因为它们交换成分后没有生成沉淀、气体或水,故D项错误。
2. [人九下 P88,T2 高仿]下面各组物质的稀溶液中,仅用石蕊溶液和同组物质之间的反应就能鉴别出来的是 (
A.KOH Ca(OH)₂ HCl
B.KOH NaCl H₂SO₄
C.HCl HNO₃ NaOH
D.HCl H₂SO₄ NaCl
B
)A.KOH Ca(OH)₂ HCl
B.KOH NaCl H₂SO₄
C.HCl HNO₃ NaOH
D.HCl H₂SO₄ NaCl
答案:
2.B 提示:KOH和Ca(OH)₂溶液都显碱性,都能使紫色石蕊溶液变蓝,HCl显酸性,能使紫色石蕊溶液变红,滴入紫色石蕊溶液,能鉴别出HCl,HCl与KOH、Ca(OH)₂反应均无明显现象,不能区分KOH和Ca(OH)₂溶液,故A项错误;HCl和HNO₃都显酸性,都使紫色石蕊溶液变红,NaOH溶液显碱性,使紫色石蕊溶液变蓝,滴入紫色石蕊溶液,能鉴别出NaOH,氢氧化钠与HCl、HNO₃反应均无明显现象,不能区分HCl和HNO₃,故C项错误;HCl和H₂SO₄都显酸性,都使紫色石蕊溶液变红,NaCl溶液显中性,不能使紫色石蕊溶液变色,滴入紫色石蕊溶液,能鉴别出NaCl溶液,氯化钠既不与HCl反应,也不与H₂SO₄反应,不能区分HCl和H₂SO₄,故D项错误。
3. [25·河南] 用传感器测得氢氧化钠溶液与稀盐酸反应的 pH 变化如图所示。下列说法正确的是 (
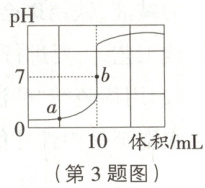
A.该实验操作是向氢氧化钠溶液中滴加稀盐酸
B.反应的化学方程式为 NaOH+HCl=NaCl+H₂O
C.在 a 点所表示的溶液中滴加石蕊溶液,溶液显蓝色
D.b 点所表示的溶液中含有的微观粒子只有钠离子和氯离子
B
)
A.该实验操作是向氢氧化钠溶液中滴加稀盐酸
B.反应的化学方程式为 NaOH+HCl=NaCl+H₂O
C.在 a 点所表示的溶液中滴加石蕊溶液,溶液显蓝色
D.b 点所表示的溶液中含有的微观粒子只有钠离子和氯离子
答案:
3.B 提示:由题图可知,溶液初始的pH小于7,显酸性,随着另一种液体的滴入,pH逐渐增大到大于7,则该实验操作是向稀盐酸中滴加氢氧化钠溶液,故A项错误;由题图可知,a点时溶液的pH小于7,显酸性,所以在a点所示的溶液中滴加石蕊溶液,溶液显红色,故C错误;由题图可知,b点时溶液的pH等于7,显中性,说明氢氧化钠和盐酸恰好完全反应,则b点所表示的溶液中含有的微观粒子有钠离子、氯离子、水分子,故D错误。
4. [人九下 P89,T6 变式]《周礼·考工记》中记载,古人取海洋中的贝壳烧成灰(主要成分是 CaO),混入草木灰(含 K₂CO₃)的水溶液中,利用生成物中能够去污的成分来清洗丝帛。
(1)贝壳灰与水反应会
(2)将贝壳灰与草木灰混入水中,充分反应后过滤,滤液中一定存在的溶质是
(1)贝壳灰与水反应会
放热
_ (选填“吸热”或“放热”)。(2)将贝壳灰与草木灰混入水中,充分反应后过滤,滤液中一定存在的溶质是
KOH
_ (填化学式)。可能存在的溶质是K₂CO₃[或Ca(OH)₂]
_ (填一种可能情况),可以用稀盐酸(或二氧化碳合理即可,与上一空对应)
_ (填一种试剂)来检验其是否存在。
答案:
4.
(1)放热
(2)KOH K₂CO₃[或Ca(OH)₂] 稀盐酸(或二氧化碳合理即可,与上一空对应)
提示:
(1)贝壳灰与水反应生成氢氧化钙的过程会放热。
(2)将贝壳灰与草木灰混入水中,氢氧化钙和碳酸钾反应生成碳酸钙沉淀和氢氧化钾,可能恰好完全反应,可能其中的一种反应物过量,所以滤液中一定存在的溶质是KOH;可能存在的溶质是K₂CO₃或Ca(OH)₂,可以用稀盐酸或二氧化碳等来检验其是否存在。
(1)放热
(2)KOH K₂CO₃[或Ca(OH)₂] 稀盐酸(或二氧化碳合理即可,与上一空对应)
提示:
(1)贝壳灰与水反应生成氢氧化钙的过程会放热。
(2)将贝壳灰与草木灰混入水中,氢氧化钙和碳酸钾反应生成碳酸钙沉淀和氢氧化钾,可能恰好完全反应,可能其中的一种反应物过量,所以滤液中一定存在的溶质是KOH;可能存在的溶质是K₂CO₃或Ca(OH)₂,可以用稀盐酸或二氧化碳等来检验其是否存在。
5. [25·苏州节选] 古籍是文明的载体。古籍纸张酸化会造成纸张发黄断裂,需进行处理。古籍纸张若出现明显酸化(以硫酸为例),需进行脱酸保护。一步脱酸法:酸化纸张用饱和石灰水浸泡,石灰水渗入纸张内部快速脱酸。两步脱酸法:酸化纸张先用饱和石灰水浸泡,取出再用 Ca(HCO₃)₂溶液浸泡,发生反应:Ca(OH)₂+Ca(HCO₃)₂=2CaCO₃↓+2H₂O。注:室温时,饱和石灰水 pH 约为 12.6。
(1)石灰水脱硫酸的原理为
(2)一步脱酸法处理后的湿纸张 pH 约为 12,晾干后 pH 降至 8 左右。过程中 pH 下降的主要原因是
(3)无论是一步脱酸法还是两步脱酸法,处理后的纸张均具有一定的抗酸性(消耗酸的能力),除微量碱残留外,具有抗酸性的原因为
(1)石灰水脱硫酸的原理为
Ca(OH)₂+H₂SO₄=CaSO₄+2H₂O
_(用化学方程式表示)。(2)一步脱酸法处理后的湿纸张 pH 约为 12,晾干后 pH 降至 8 左右。过程中 pH 下降的主要原因是
Ca(OH)₂和空气中的二氧化碳反应生成碳酸钙和水
_。(3)无论是一步脱酸法还是两步脱酸法,处理后的纸张均具有一定的抗酸性(消耗酸的能力),除微量碱残留外,具有抗酸性的原因为
纸张上残留的碳酸钙能消耗酸
_。
答案:
5.
(1)Ca(OH)₂+H₂SO₄=CaSO₄+2H₂O
(2)Ca(OH)₂和空气中的二氧化碳反应生成碳酸钙和水
(3)纸张上残留的碳酸钙能消耗酸
提示:
(1)石灰水[主要成分是Ca(OH)₂]和硫酸发生中和反应生成硫酸钙和水,反应的化学方程式为Ca(OH)₂+H₂SO₄=CaSO₄+2H₂O。
(2)因为Ca(OH)₂和空气中的二氧化碳反应生成碳酸钙,随着氢氧化钙的消耗,碱性减弱,则pH下降。
(3)纸张上残留的碳酸钙能与酸发生反应,从而消耗酸,使得纸张具有抗酸性。
(1)Ca(OH)₂+H₂SO₄=CaSO₄+2H₂O
(2)Ca(OH)₂和空气中的二氧化碳反应生成碳酸钙和水
(3)纸张上残留的碳酸钙能消耗酸
提示:
(1)石灰水[主要成分是Ca(OH)₂]和硫酸发生中和反应生成硫酸钙和水,反应的化学方程式为Ca(OH)₂+H₂SO₄=CaSO₄+2H₂O。
(2)因为Ca(OH)₂和空气中的二氧化碳反应生成碳酸钙,随着氢氧化钙的消耗,碱性减弱,则pH下降。
(3)纸张上残留的碳酸钙能与酸发生反应,从而消耗酸,使得纸张具有抗酸性。
6. [25·威海] 图 1 是探究敞口放置的氢氧化钠溶液变质程度的装置,图 2 是实验过程中溶液 pH 随时间变化的情况(已知 BaCl₂溶液显中性)。下列说法不正确的是 (
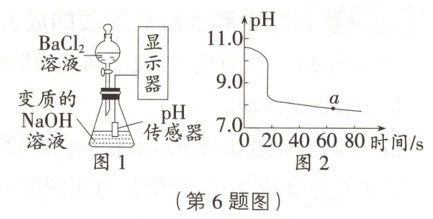
A.随着反应的进行,溶液的碱性逐渐减弱
B.实验过程中有白色沉淀生成
C.a 点时,锥形瓶内溶液中的溶质为 NaCl 和 BaCl₂
D.由实验可知,该份氢氧化钠溶液部分变质
C
)
A.随着反应的进行,溶液的碱性逐渐减弱
B.实验过程中有白色沉淀生成
C.a 点时,锥形瓶内溶液中的溶质为 NaCl 和 BaCl₂
D.由实验可知,该份氢氧化钠溶液部分变质
答案:
6.C 提示:NaOH与CO₂反应生成Na₂CO₃,Na₂CO₃会与BaCl₂反应生成BaCO₃和NaCl。a点时,溶液的pH大于7,溶液呈碱性,说明原溶液中含NaOH,锥形瓶内溶液中的溶质为NaCl、NaOH和BaCl₂,故C项错误。
查看更多完整答案,请扫码查看


