第31页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
7. [25·河南]某同学设计如图所示装置进行实验(夹持仪器略去,K₁、K₂均关闭)。打开 K₁,待液体全部流下,关闭 K₁,观察到烧杯中的溶液变浑浊;充分反应后,打开 K₁、K₂,使液体全部流入锥形瓶,瓶中无明显现象。
(1)用化学方程式说明烧杯中的溶液变浑浊的原因:
(2)充分反应后,取锥形瓶中的溶液,测得 pH=4。写出该溶液中溶质的成分:

(1)用化学方程式说明烧杯中的溶液变浑浊的原因:
Ca(OH)₂+CO₂=CaCO₃↓+H₂O
_ 。(2)充分反应后,取锥形瓶中的溶液,测得 pH=4。写出该溶液中溶质的成分:
氯化钠、氯化钙、氯化氢
_ 。
答案:
7.
(1)Ca(OH)₂+CO₂=CaCO₃↓+H₂O
(2)氯化钠、氯化钙、氯化氢
提示:
(1)烧杯中的溶液变浑浊,是因为碳酸钠和盐酸反应生成的二氧化碳与氢氧化钙反应生成白色沉淀碳酸钙和水,反应的化学方程式是Ca(OH)₂+CO₂=CaCO₃↓+H₂O。
(2)充分反应后,取锥形瓶中的溶液,测得pH=4,说明溶液显酸性,即盐酸过量。该溶液中溶质的成分有稀盐酸和碳酸钠反应生成的氯化钠、稀盐酸和氢氧化钙反应生成的氯化钙和过量的盐酸中的氯化氢。
(1)Ca(OH)₂+CO₂=CaCO₃↓+H₂O
(2)氯化钠、氯化钙、氯化氢
提示:
(1)烧杯中的溶液变浑浊,是因为碳酸钠和盐酸反应生成的二氧化碳与氢氧化钙反应生成白色沉淀碳酸钙和水,反应的化学方程式是Ca(OH)₂+CO₂=CaCO₃↓+H₂O。
(2)充分反应后,取锥形瓶中的溶液,测得pH=4,说明溶液显酸性,即盐酸过量。该溶液中溶质的成分有稀盐酸和碳酸钠反应生成的氯化钠、稀盐酸和氢氧化钙反应生成的氯化钙和过量的盐酸中的氯化氢。
8. [25·安徽节选]某化学兴趣小组为探究 NaHCO₃和 NaOH 的性质,设计并进行了如下实验。
【实验一】探究 NaHCO₃溶液的酸碱性
(1)取少量 NaHCO₃溶液于试管中,向其中滴加 1~2 滴酚酞溶液,溶液变为浅红色。实验结论:溶液呈
【实验二】数字化实验探究 NaOH 的性质
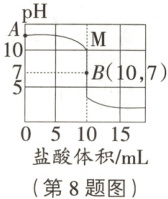
常温下,取一定量的 NaOH 溶液,分成两等份。向一份 NaOH 溶液滴入稀盐酸,用 pH 传感器测定该过程中的 pH 变化,测定结果如图曲线 M。向另一份 NaOH 溶液中先通入一定量的 CO₂充分反应后得到溶液 X。再向溶液 X 中滴入相同质量分数的稀盐酸,同时用 pH 传感器测定 pH 变化,得到 pH 随盐酸体积(mL)变化曲线 N(未在如图坐标系中画出)。(查阅资料:CO₂过量时,发生反应 Na₂CO₃+CO₂+H₂O=2NaHCO₃)
(2)溶液 X 的 pH
【实验一】探究 NaHCO₃溶液的酸碱性
(1)取少量 NaHCO₃溶液于试管中,向其中滴加 1~2 滴酚酞溶液,溶液变为浅红色。实验结论:溶液呈
碱
_ 性。【实验二】数字化实验探究 NaOH 的性质
常温下,取一定量的 NaOH 溶液,分成两等份。向一份 NaOH 溶液滴入稀盐酸,用 pH 传感器测定该过程中的 pH 变化,测定结果如图曲线 M。向另一份 NaOH 溶液中先通入一定量的 CO₂充分反应后得到溶液 X。再向溶液 X 中滴入相同质量分数的稀盐酸,同时用 pH 传感器测定 pH 变化,得到 pH 随盐酸体积(mL)变化曲线 N(未在如图坐标系中画出)。(查阅资料:CO₂过量时,发生反应 Na₂CO₃+CO₂+H₂O=2NaHCO₃)
(2)溶液 X 的 pH
小于
_ (选填“大于”“小于”或“等于”)A 点的 pH。
答案:
8.
(1)碱
(2)小于
提示:
(1)酚酞溶液遇碱性溶液变红,取少量NaHCO₃溶液于试管中,向其中滴加1~2滴酚酞溶液,溶液变为浅红色,说明NaHCO₃溶液呈碱性。
(2)NaOH溶液与CO₂反应生成碳酸钠和水,当CO₂过量时,还会发生反应:Na₂CO₃+CO₂+H₂O=2NaHCO₃。所以溶液X中的溶质可能是Na₂CO₃、NaHCO₃和NaOH中的一种或几种。Na₂CO₃溶液显碱性,NaHCO₃溶液也显碱性,但是它们的碱性比NaOH溶液弱。A点对应的是NaOH溶液,未与盐酸反应,所以溶液X的pH大于A点的pH。
(1)碱
(2)小于
提示:
(1)酚酞溶液遇碱性溶液变红,取少量NaHCO₃溶液于试管中,向其中滴加1~2滴酚酞溶液,溶液变为浅红色,说明NaHCO₃溶液呈碱性。
(2)NaOH溶液与CO₂反应生成碳酸钠和水,当CO₂过量时,还会发生反应:Na₂CO₃+CO₂+H₂O=2NaHCO₃。所以溶液X中的溶质可能是Na₂CO₃、NaHCO₃和NaOH中的一种或几种。Na₂CO₃溶液显碱性,NaHCO₃溶液也显碱性,但是它们的碱性比NaOH溶液弱。A点对应的是NaOH溶液,未与盐酸反应,所以溶液X的pH大于A点的pH。
9. 创新实验 实验小组对碱与盐的性质进行实验,装置如图所示,操作如下:

①关闭弹簧夹 K,点燃燃烧匙内的酒精,迅速塞紧橡胶塞;
②冷却至常温,将滴管中的 NaOH 溶液注入瓶中,振荡;
③打开弹簧夹 K,观察现象。
(1)打开弹簧夹 K,会观察到
(2)最终观察到装置甲内的现象为

①关闭弹簧夹 K,点燃燃烧匙内的酒精,迅速塞紧橡胶塞;
②冷却至常温,将滴管中的 NaOH 溶液注入瓶中,振荡;
③打开弹簧夹 K,观察现象。
(1)打开弹簧夹 K,会观察到
氯化钙溶液被倒吸入甲装置中
_现象。(2)最终观察到装置甲内的现象为
产生白色沉淀
_,用化学方程式解释原因:Na₂CO₃+CaCl₂=2NaCl+CaCO₃↓
_ 。
答案:
9.
(1)氯化钙溶液被倒吸入甲装置中
(2)产生白色沉淀 Na₂CO₃+CaCl₂=2NaCl+CaCO₃↓
提示:
(1)酒精燃烧生成CO₂,氢氧化钠与二氧化碳反应生成碳酸钠和水,甲装置中气体减少,压强减小,所以打开弹簧夹K,氯化钙溶液被倒吸入甲中。
(2)氢氧化钠与二氧化碳反应生成的碳酸钠会与被倒吸入甲装置中的氯化钙溶液反应,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,最终观察到甲装置内产生白色沉淀,反应的化学方程式为Na₂CO₃+CaCl₂=2NaCl+CaCO₃↓。
(1)氯化钙溶液被倒吸入甲装置中
(2)产生白色沉淀 Na₂CO₃+CaCl₂=2NaCl+CaCO₃↓
提示:
(1)酒精燃烧生成CO₂,氢氧化钠与二氧化碳反应生成碳酸钠和水,甲装置中气体减少,压强减小,所以打开弹簧夹K,氯化钙溶液被倒吸入甲中。
(2)氢氧化钠与二氧化碳反应生成的碳酸钠会与被倒吸入甲装置中的氯化钙溶液反应,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,最终观察到甲装置内产生白色沉淀,反应的化学方程式为Na₂CO₃+CaCl₂=2NaCl+CaCO₃↓。
查看更多完整答案,请扫码查看


