第14页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
1. [人九下 P35,T1 高仿] 下列关于溶液的说法不正确的是(
A.溶液是一种均一、稳定的混合物
B.可以用溶解度判断某种物质在某种溶剂中的溶解能力
C.不饱和溶液变成饱和溶液后,溶质质量分数一定变大
D.两种溶质质量分数不同的食盐水会有不同的性质,从而有不同的应用
C
)A.溶液是一种均一、稳定的混合物
B.可以用溶解度判断某种物质在某种溶剂中的溶解能力
C.不饱和溶液变成饱和溶液后,溶质质量分数一定变大
D.两种溶质质量分数不同的食盐水会有不同的性质,从而有不同的应用
答案:
1.C 提示:不饱和溶液变成饱和溶液后,溶质质量分数不一定变大,如采用的是降温至恰好饱和的方法,溶液的组成没有发生改变,溶质质量分数不变,故C项错误。
2. [25·山西] 不同温度时 KCl 的溶解度如表所示。下列分析正确的是(
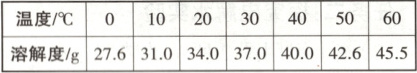
A.20℃时,KCl 的溶解度为 34.0
B.30℃时,50g 水中加入 19g KCl,所得溶液质量为 69g
C.40℃时,KCl 饱和溶液的溶质质量分数为 40%
D.将 100g KCl 溶液由 60℃冷却到 50℃,可能有晶体析出
D
)
A.20℃时,KCl 的溶解度为 34.0
B.30℃时,50g 水中加入 19g KCl,所得溶液质量为 69g
C.40℃时,KCl 饱和溶液的溶质质量分数为 40%
D.将 100g KCl 溶液由 60℃冷却到 50℃,可能有晶体析出
答案:
2.D 提示:溶解度的单位是g,由题表可知,20℃时,KCl的溶解度为34.0g,故A项错误;由题表可知,30℃时,氯化钾的溶解度为37.0g,30℃时,50g水中加入19gKCl,最多能溶解18.5g,所得溶液质量为68.5g,故B项错误;40℃时,氯化钾的溶解度为40.0g,40℃时,KCl饱和溶液的溶质质量分数为$\frac{40.0g}{40.0g + 100g}×100\%<40\%,$故C项错误。
3. [人九下 P54,T8 变式] 配制 50g 质量分数为 6%的 NaCl 溶液,并用该溶液配制 50g 质量分数为 3%的稀溶液,可能用到的仪器如图。下列说法正确的是(
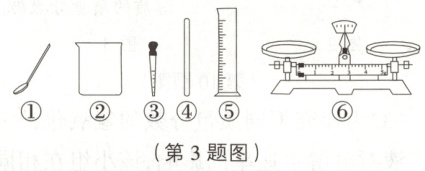
A.配制 6%的溶液选择仪器①③⑤⑥
B.将 NaCl 固体倒入量筒中溶解
C.稀释时,用量筒量取 48.5mL 水
D.量取 6%的溶液时仰视读数,所配稀溶液浓度偏大
D
)
A.配制 6%的溶液选择仪器①③⑤⑥
B.将 NaCl 固体倒入量筒中溶解
C.稀释时,用量筒量取 48.5mL 水
D.量取 6%的溶液时仰视读数,所配稀溶液浓度偏大
答案:
3.D 提示:实验步骤为计算、称量、量取,在这些操作中需要的仪器有托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒,故A项错误;将NaCl固体倒入烧杯中溶解,不能在量筒内溶解,故B项错误;稀释时,用量筒量取水的质量是$50g - \frac{50g×3\%}{6\%}=25g,$合25mL,故C项错误。
4. [25·天水] 如图为 NaCl、NH₄Cl 和 NaHCO₃的溶解度曲线。

(1)t₁℃时,NaCl 的溶解度
(2)将 t₂℃时 NH₄Cl 的不饱和溶液变为该温度下的饱和溶液,可采取的措施是
(3)当 NH₄Cl 溶液中混有少量 NaCl 时,可采用
(4)t₃℃时,NaHCO₃饱和溶液中溶质与溶剂的质量比为

(1)t₁℃时,NaCl 的溶解度
>
(选填“>”或“<”)NH₄Cl 的溶解度。(2)将 t₂℃时 NH₄Cl 的不饱和溶液变为该温度下的饱和溶液,可采取的措施是
加入氯化铵(或恒温蒸发溶剂)
(写一种即可)。(3)当 NH₄Cl 溶液中混有少量 NaCl 时,可采用
降温结晶
的方法提纯 NH₄Cl。(4)t₃℃时,NaHCO₃饱和溶液中溶质与溶剂的质量比为
3:25
(填最简整数比)。
答案:
4.
(1)>
(2)加入氯化铵(或恒温蒸发溶剂)
(3)降温结晶
(4)3:25
提示:
(1)由题图可知,t₁℃时,NaCl的溶解度>NH₄Cl的溶解度。
(2)将t₂℃时NH₄Cl的不饱和溶液变为该温度下的饱和溶液,可采取的措施是加入氯化铵、恒温蒸发溶剂。
(3)NH₄Cl的溶解度受温度的影响变化较大,而NaCl的溶解度受温度的影响变化较小,当NH₄Cl溶液中混有少量NaCl时,可采用降温结晶的方法。
(4)t₃℃时,碳酸氢钠的溶解度为12g,t₃℃时,NaHCO₃饱和溶液中溶质与溶剂的质量比为12g:100g = 3:25。
(1)>
(2)加入氯化铵(或恒温蒸发溶剂)
(3)降温结晶
(4)3:25
提示:
(1)由题图可知,t₁℃时,NaCl的溶解度>NH₄Cl的溶解度。
(2)将t₂℃时NH₄Cl的不饱和溶液变为该温度下的饱和溶液,可采取的措施是加入氯化铵、恒温蒸发溶剂。
(3)NH₄Cl的溶解度受温度的影响变化较大,而NaCl的溶解度受温度的影响变化较小,当NH₄Cl溶液中混有少量NaCl时,可采用降温结晶的方法。
(4)t₃℃时,碳酸氢钠的溶解度为12g,t₃℃时,NaHCO₃饱和溶液中溶质与溶剂的质量比为12g:100g = 3:25。
5. [25·唐山丰润区二模] 如图是硝酸钾和氯化钾的溶解度曲线。某小组进行如图所示的实验,X 是硝酸钾和氯化钾中的一种,下列说法正确的是(
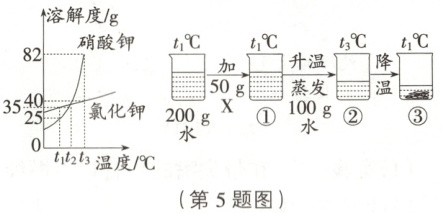
A.X 是氯化钾
B.溶质的质量分数:②>③>①
C.只有烧杯③中的上层清液是饱和溶液
D.烧杯③中析出的固体质量是 25g
D
)
A.X 是氯化钾
B.溶质的质量分数:②>③>①
C.只有烧杯③中的上层清液是饱和溶液
D.烧杯③中析出的固体质量是 25g
答案:
5.D 提示:t₃℃时,②中的溶液中溶剂的质量是100g,溶液中含有的溶质的质量为50g,此时溶液中没有析出晶体,说明该温度下,该物质的溶解度一定大于等于50g,该温度下硝酸钾的溶解度是82g,氯化钾的溶解度是40g,该物质为硝酸钾,故A项错误;①蒸发100g水后得到②,此时无晶体析出,故②比①溶质的质量分数大;②降温析出晶体后得到③,则③是t₁℃时的饱和溶液;
t₁℃时①中的溶液中溶剂的质量是200g,溶质的质量是50g,通过A项的分析可知该物质是硝酸钾,已知硝酸钾在t₁℃时的溶解度是25g,说明此溶液为硝酸钾在t₁℃时的饱和溶液,①③都是硝酸钾在t₁℃时的饱和溶液,两溶液中溶质的质量分数相同,即②>③=①,故B、C项错误。
t₁℃时①中的溶液中溶剂的质量是200g,溶质的质量是50g,通过A项的分析可知该物质是硝酸钾,已知硝酸钾在t₁℃时的溶解度是25g,说明此溶液为硝酸钾在t₁℃时的饱和溶液,①③都是硝酸钾在t₁℃时的饱和溶液,两溶液中溶质的质量分数相同,即②>③=①,故B、C项错误。
查看更多完整答案,请扫码查看


