第34页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
1. [25·凉山州]化学兴趣小组在实验室发现一瓶敞口放置的氢氧化钠溶液,同学们认为该瓶溶液可能已变质并对其中的成分进行探究。
(1)氢氧化钠溶液敞口放置在空气中可能变质的原因是
(2)实验探究:
【提出问题】该瓶溶液中含有哪些溶质?
【猜想与假设】猜想一:NaOH;猜想二:NaOH、Na₂CO₃;猜想三:
【查阅资料】Na₂CO₃溶液呈碱性,CaCl₂溶液呈中性。
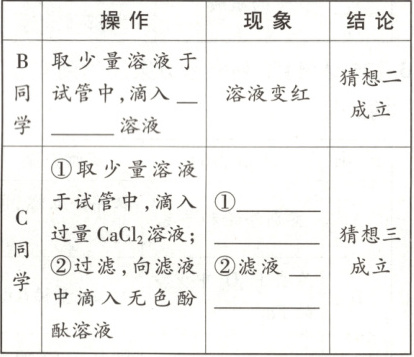
【实验一】A同学取适量该瓶溶液于试管中,加入过量
【实验二】B、C两位同学在A同学结论的基础上分别重新取该瓶溶液进行实验。
两位同学中,结论正确的是
【反思与评价】同学们结合所学知识,经过反思,又设计了下列实验方案来确定变质氢氧化钠溶液中的溶质成分。从理论上分析,你认为其中可行的有
A. 向溶液中加入适量Ca(OH)₂溶液,过滤后向滤液中滴入无色酚酞溶液
B. 向溶液中加入适量CaCl₂溶液,过滤后向滤液中滴入CuSO₄溶液
C. 向溶液中加入过量CaCl₂溶液,过滤后向滤液中通入少量CO₂
D. 向溶液中滴入几滴无色酚酞溶液后继续加入过
(1)氢氧化钠溶液敞口放置在空气中可能变质的原因是
2NaOH+CO₂=Na₂CO₃+H₂O
(用化学方程式表示)。(2)实验探究:
【提出问题】该瓶溶液中含有哪些溶质?
【猜想与假设】猜想一:NaOH;猜想二:NaOH、Na₂CO₃;猜想三:
Na₂CO₃
。【查阅资料】Na₂CO₃溶液呈碱性,CaCl₂溶液呈中性。
【实验一】A同学取适量该瓶溶液于试管中,加入过量
稀
盐酸,观察到有无色气泡产生,由此可知猜想一
(选填“一”“二”或“三”)不成立。【实验二】B、C两位同学在A同学结论的基础上分别重新取该瓶溶液进行实验。
两位同学中,结论正确的是
C
(选填“B”或“C”)同学。【反思与评价】同学们结合所学知识,经过反思,又设计了下列实验方案来确定变质氢氧化钠溶液中的溶质成分。从理论上分析,你认为其中可行的有
BCD
(填选项字母)。A. 向溶液中加入适量Ca(OH)₂溶液,过滤后向滤液中滴入无色酚酞溶液
B. 向溶液中加入适量CaCl₂溶液,过滤后向滤液中滴入CuSO₄溶液
C. 向溶液中加入过量CaCl₂溶液,过滤后向滤液中通入少量CO₂
D. 向溶液中滴入几滴无色酚酞溶液后继续加入过
量
CaCl₂溶液
答案:
1.
(1)2NaOH+CO₂=Na₂CO₃+H₂O
(2)【猜想与假设】Na₂CO₃
【实验一】一 【实验二】无色酚酞有白色沉淀生成 不变红 C
【反思与评价】BCD
提示:
(1)氢氧化钠溶液敞口放置在空气中,二氧化碳与氢氧化钠反应生成碳酸钠和水,反应的化学方程式为 2NaOH+CO₂=Na₂CO₃+H₂O。
(2)【猜想与假设】若 NaOH 完全变质,溶质为 Na₂CO₃。【实验一】A 同学取适量该瓶溶液于试管中,加入过量稀盐酸,稀盐酸与碳酸钠反应产生二氧化碳气体,观察到有无色气泡产生,说明一定含有碳酸钠,由此可知猜想一不成立。【实验二】B 同学取少量溶液于试管中,根据现象溶液变红,则滴入的应是无色酚酞溶液;
“猜想二成立”不正确,因为 Na₂CO₃溶液呈碱性,能使酚酞变红,也可能是溶液中只有碳酸钠;C 同学加入过量氯化钙溶液,碳酸钠与氯化钙反应产生碳酸钙白色沉淀,说明含有碳酸钠,然后在上层清液加入酚酞溶液,滤液不变红,说明不含有氢氧化钠,所以溶质为碳酸钠,C 同学结论正确。【反思与评价】向溶液中加入适量 Ca(OH)₂溶液,过滤后向滤液中滴入无色酚酞溶液,加入氢氧化钙溶液引入氢氧根离子,无法检验氢氧化钠的存在,故 A 项方案不正确。
(1)2NaOH+CO₂=Na₂CO₃+H₂O
(2)【猜想与假设】Na₂CO₃
【实验一】一 【实验二】无色酚酞有白色沉淀生成 不变红 C
【反思与评价】BCD
提示:
(1)氢氧化钠溶液敞口放置在空气中,二氧化碳与氢氧化钠反应生成碳酸钠和水,反应的化学方程式为 2NaOH+CO₂=Na₂CO₃+H₂O。
(2)【猜想与假设】若 NaOH 完全变质,溶质为 Na₂CO₃。【实验一】A 同学取适量该瓶溶液于试管中,加入过量稀盐酸,稀盐酸与碳酸钠反应产生二氧化碳气体,观察到有无色气泡产生,说明一定含有碳酸钠,由此可知猜想一不成立。【实验二】B 同学取少量溶液于试管中,根据现象溶液变红,则滴入的应是无色酚酞溶液;
“猜想二成立”不正确,因为 Na₂CO₃溶液呈碱性,能使酚酞变红,也可能是溶液中只有碳酸钠;C 同学加入过量氯化钙溶液,碳酸钠与氯化钙反应产生碳酸钙白色沉淀,说明含有碳酸钠,然后在上层清液加入酚酞溶液,滤液不变红,说明不含有氢氧化钠,所以溶质为碳酸钠,C 同学结论正确。【反思与评价】向溶液中加入适量 Ca(OH)₂溶液,过滤后向滤液中滴入无色酚酞溶液,加入氢氧化钙溶液引入氢氧根离子,无法检验氢氧化钠的存在,故 A 项方案不正确。
2. 兴趣小组对一瓶久置的NaOH固体的变质情况进行定量实验探究。
【提出问题】NaOH变质了吗?
【作出猜想】①没有变质;②已经变质。
【实验活动】兴趣小组利用控制变量的方法进行实验,实验数据如下表所示。

【实验结论】小组同学分析温度升高值数据,确定该NaOH固体变质程度是
【拓展延伸】生活中的管道疏通剂和炉具清洁剂中都含有NaOH,包装标签上应注明的注意事项是

【提出问题】NaOH变质了吗?
【作出猜想】①没有变质;②已经变质。
【实验活动】兴趣小组利用控制变量的方法进行实验,实验数据如下表所示。

【实验结论】小组同学分析温度升高值数据,确定该NaOH固体变质程度是
部分变质
,请推测m的取值范围是11.92<m<13.69
。【拓展延伸】生活中的管道疏通剂和炉具清洁剂中都含有NaOH,包装标签上应注明的注意事项是
密封保存(合理即可)
(写一条)。
答案:
2.【实验活动】1.0
【实验结论】部分变质 11.92<m<
13.69
【拓展延伸】密封保存(合理即可)
提示:【实验活动】探究实验要求控制变量,根据题表信息可知,Na₂CO₃固体的质量应为 1.0g。【实验结论】根据题表信息可知,样品全部为氢氧化钠时,温度升高 31.52℃;样品全部为碳酸钠时,温度升高 10.03℃;而该 1.0g 氢氧化钠样品温度升高 15.71℃,介于两者中间,因此该 NaOH 固体部分变质;m 的取值范围是 11.92<m<13.69。【拓展延伸】生活中的管道疏通剂和炉具清洁剂成分中都含有 NaOH,为防止变质,包装标签上应注明的注意事项是密封保存等。
【实验结论】部分变质 11.92<m<
13.69
【拓展延伸】密封保存(合理即可)
提示:【实验活动】探究实验要求控制变量,根据题表信息可知,Na₂CO₃固体的质量应为 1.0g。【实验结论】根据题表信息可知,样品全部为氢氧化钠时,温度升高 31.52℃;样品全部为碳酸钠时,温度升高 10.03℃;而该 1.0g 氢氧化钠样品温度升高 15.71℃,介于两者中间,因此该 NaOH 固体部分变质;m 的取值范围是 11.92<m<13.69。【拓展延伸】生活中的管道疏通剂和炉具清洁剂成分中都含有 NaOH,为防止变质,包装标签上应注明的注意事项是密封保存等。
查看更多完整答案,请扫码查看


