第39页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
3. 有一袋密封保存的淡黄色粉末,该粉末可用于消毒杀菌,兴趣小组对其成分进行了探究。
【提出问题】淡黄色固体是什么?
【查阅资料】①硫粉是一种淡黄色固体,难溶于水。②过氧化钠(Na₂O₂)是一种淡黄色固体,能与水反应生成氢氧化钠和氧气,也能与二氧化碳反应生成碳酸钠和氧气。
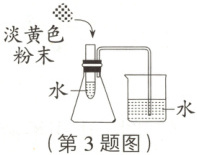
【方案设计】方案一:取少量该固体粉末于试管中,加 5 mL 水,振荡并观察现象。
方案二:在燃烧匙里放少量该固体,在酒精灯上加热,观察现象。
(1)经讨论,兴趣小组决定采用方案一,方案一的优点是
【实验验证】用如图装置实验,将淡黄色粉末加入试管中。
(2)若淡黄色粉末为硫粉,则可观察到
(3)若淡黄色粉末为过氧化钠,可观察到试管中的现象是
【实验结论】该淡黄色粉末为过氧化钠。
【拓展延伸】这袋淡黄色固体敞口放置一段时间后的成分是什么?
【作出猜想】(4)①只有 NaOH;②只有 Na₂CO₃;③NaOH 和 Na₂CO₃,猜想依据为
(5)【设计实验】
(6)写出步骤②的化学方程式:
【提出问题】淡黄色固体是什么?
【查阅资料】①硫粉是一种淡黄色固体,难溶于水。②过氧化钠(Na₂O₂)是一种淡黄色固体,能与水反应生成氢氧化钠和氧气,也能与二氧化碳反应生成碳酸钠和氧气。
【方案设计】方案一:取少量该固体粉末于试管中,加 5 mL 水,振荡并观察现象。
方案二:在燃烧匙里放少量该固体,在酒精灯上加热,观察现象。
(1)经讨论,兴趣小组决定采用方案一,方案一的优点是
操作简单,能防止污染环境
。【实验验证】用如图装置实验,将淡黄色粉末加入试管中。

(2)若淡黄色粉末为硫粉,则可观察到
淡黄色粉末不溶解
。(3)若淡黄色粉末为过氧化钠,可观察到试管中的现象是
试管中固体溶解,产生气泡
,烧杯中的导管口出现气泡,说明过氧化钠与水反应放热
。【实验结论】该淡黄色粉末为过氧化钠。
【拓展延伸】这袋淡黄色固体敞口放置一段时间后的成分是什么?
【作出猜想】(4)①只有 NaOH;②只有 Na₂CO₃;③NaOH 和 Na₂CO₃,猜想依据为
空气中含有水蒸气和二氧化碳,过氧化钠能与水反应生成氢氧化钠,也能与二氧化碳反应生成碳酸钠
。(5)【设计实验】
(6)写出步骤②的化学方程式:
$\mathrm{BaCl_2 + Na_2CO_3 = BaCO_3↓ + 2NaCl}$
。
答案:
3.
(1)操作简单,能防止污染环境
(2)淡黄色粉末不溶解
(3)试管中固体溶解,产生气泡 过氧化钠与水反应放热
(4)空气中含有水蒸气和二氧化碳,过氧化钠能与水反应生成氢氧化钠,也能与二氧化碳反应生成碳酸钠
(5)红
(6)$\mathrm{BaCl_2 + Na_2CO_3 = BaCO_3↓ + 2NaCl}$
提示:
(1)方案一与方案二相比的优点是操作简单,能够防止可能生成的二氧化硫污染环境。
(2)若淡黄色粉末为硫粉,由于硫难溶于水,则可观察到淡黄色粉末不溶解。
(3)若淡黄色粉末为过氧化钠,过氧化钠和水反应生成氢氧化钠和氧气,可观察到试管中固体溶解,产生气泡。导管口有气泡产生,说明过氧化钠与水反应放热。
(4)空气中含有水蒸气和二氧化碳,过氧化钠能与水反应生成氢氧化钠,也能与二氧化碳反应生成碳酸钠。
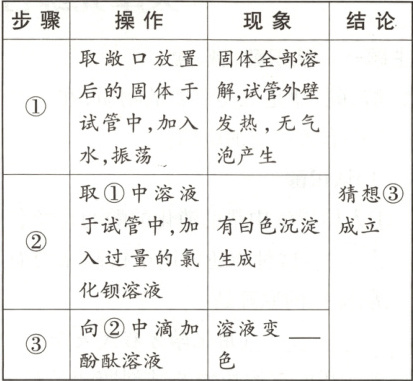
(5)取敞口放置后的固体于试管中,加入水,振荡,固体全部溶解,试管外壁发热,无气泡产生,说明固体中不含有过氧化钠;取①中溶液于试管中,加入过量的氯化钡溶液,产生白色沉淀,碳酸钠和氯化钡反应生成了白色沉淀碳酸钡和氯化钠,说明溶液中存在碳酸钠;向②中滴加酚酞溶液,溶液变红色,说明溶液中含有氢氧化钠;从而说明猜想③成立。
(6)步骤②中发生的反应的化学方程式为$\mathrm{BaCl_2 + Na_2CO_3 = BaCO_3↓ + 2NaCl}$。
(1)操作简单,能防止污染环境
(2)淡黄色粉末不溶解
(3)试管中固体溶解,产生气泡 过氧化钠与水反应放热
(4)空气中含有水蒸气和二氧化碳,过氧化钠能与水反应生成氢氧化钠,也能与二氧化碳反应生成碳酸钠
(5)红
(6)$\mathrm{BaCl_2 + Na_2CO_3 = BaCO_3↓ + 2NaCl}$
提示:
(1)方案一与方案二相比的优点是操作简单,能够防止可能生成的二氧化硫污染环境。
(2)若淡黄色粉末为硫粉,由于硫难溶于水,则可观察到淡黄色粉末不溶解。
(3)若淡黄色粉末为过氧化钠,过氧化钠和水反应生成氢氧化钠和氧气,可观察到试管中固体溶解,产生气泡。导管口有气泡产生,说明过氧化钠与水反应放热。
(4)空气中含有水蒸气和二氧化碳,过氧化钠能与水反应生成氢氧化钠,也能与二氧化碳反应生成碳酸钠。
(5)取敞口放置后的固体于试管中,加入水,振荡,固体全部溶解,试管外壁发热,无气泡产生,说明固体中不含有过氧化钠;取①中溶液于试管中,加入过量的氯化钡溶液,产生白色沉淀,碳酸钠和氯化钡反应生成了白色沉淀碳酸钡和氯化钠,说明溶液中存在碳酸钠;向②中滴加酚酞溶液,溶液变红色,说明溶液中含有氢氧化钠;从而说明猜想③成立。
(6)步骤②中发生的反应的化学方程式为$\mathrm{BaCl_2 + Na_2CO_3 = BaCO_3↓ + 2NaCl}$。
4. 久置的镁条表面有一层灰黑色“外衣”,将镁条放入试管中,加入一定浓度的盐酸,观察到有气泡产生,试管壁发烫。同学们对此气体成分产生了兴趣。
【提出问题】此气体成分是什么?
【查阅资料】灰黑色“外衣”中含有 MgCO₃。
【猜想假设】猜想一:H₂、CO₂;猜想二:H₂、CO₂、
【设计实验】为检验此气体成分,设计如图装置进行实验(假设每步反应均完全)。
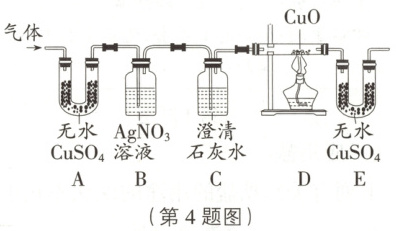
(1)B 装置中出现白色沉淀,证明气体中含有
(2)证明该气体中含有 H₂的现象是
【提出问题】此气体成分是什么?
【查阅资料】灰黑色“外衣”中含有 MgCO₃。
【猜想假设】猜想一:H₂、CO₂;猜想二:H₂、CO₂、
$\mathrm{H_2O}$
;猜想三:H₂、CO₂和 HCl。【设计实验】为检验此气体成分,设计如图装置进行实验(假设每步反应均完全)。

(1)B 装置中出现白色沉淀,证明气体中含有
$\mathrm{HCl}$
,乙同学认为可以用紫色石蕊溶液代替硝酸银溶液,也可以证明该气体,你是否同意他的观点并说明理由:不同意,因为二氧化碳与水反应生成碳酸,也能使紫色石蕊溶液变红
。(2)证明该气体中含有 H₂的现象是
D中黑色固体变红,E中无水硫酸铜变蓝
。
答案:
4.【猜想假设】$\mathrm{H_2O}$
【设计实验】
(1)$\mathrm{HCl}$ 不同意,因为二氧化碳与水反应生成碳酸,也能使紫色石蕊溶液变红
(2)D中黑色固体变红,E中无水硫酸铜变蓝
提示:【猜想假设】气体会从溶液中带入水蒸气,根据猜想一:$\mathrm{H_2}$、$\mathrm{CO_2}$,猜想三:$\mathrm{H_2}$、$\mathrm{CO_2}$和$\mathrm{HCl}$,则猜想二为$\mathrm{H_2}$、$\mathrm{CO_2}$、$\mathrm{H_2O}$。【设计实验】
(1)氯化氢气体能与硝酸银溶液反应生成氯化银白色沉淀,B装置中出现白色沉淀,证明气体中含有$\mathrm{HCl}$;乙同学认为可以用紫色石蕊溶液代替硝酸银溶液,也可以证明该气体,不同意他的观点,因为二氧化碳与水反应生成碳酸,也能使紫色石蕊溶液变红。
(2)氢气能与氧化铜在加热条件下反应生成铜和水,若D中黑色固体变红,E中无水硫酸铜变蓝,说明气体与氧化铜反应生成了水,从而证明该气体中含有氢气。
【设计实验】
(1)$\mathrm{HCl}$ 不同意,因为二氧化碳与水反应生成碳酸,也能使紫色石蕊溶液变红
(2)D中黑色固体变红,E中无水硫酸铜变蓝
提示:【猜想假设】气体会从溶液中带入水蒸气,根据猜想一:$\mathrm{H_2}$、$\mathrm{CO_2}$,猜想三:$\mathrm{H_2}$、$\mathrm{CO_2}$和$\mathrm{HCl}$,则猜想二为$\mathrm{H_2}$、$\mathrm{CO_2}$、$\mathrm{H_2O}$。【设计实验】
(1)氯化氢气体能与硝酸银溶液反应生成氯化银白色沉淀,B装置中出现白色沉淀,证明气体中含有$\mathrm{HCl}$;乙同学认为可以用紫色石蕊溶液代替硝酸银溶液,也可以证明该气体,不同意他的观点,因为二氧化碳与水反应生成碳酸,也能使紫色石蕊溶液变红。
(2)氢气能与氧化铜在加热条件下反应生成铜和水,若D中黑色固体变红,E中无水硫酸铜变蓝,说明气体与氧化铜反应生成了水,从而证明该气体中含有氢气。
查看更多完整答案,请扫码查看


