第20页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
1. 重点[科粤九下 P15,T3 高仿]将金属 M 和铜片投入稀盐酸中,金属 M 和稀盐酸反应有气泡产生,铜片无明显现象;将镁条插入 M 的盐溶液中,有 M 析出,则 M、Mg、Cu 的金属活动性由强到弱的顺序是(
A.M、Mg、Cu
B.Mg、M、Cu
C.Cu、Mg、M
D.Cu、M、Mg
B
)A.M、Mg、Cu
B.Mg、M、Cu
C.Cu、Mg、M
D.Cu、M、Mg
答案:
B 提示:将金属M和铜片投入稀盐酸中,金属M和稀盐酸反应有气泡产生,铜片无明显现象,说明M的金属活动性在氢前,铜的金属活动性在氢后,即M>Cu;将镁条插入M的盐溶液中,有M析出,说明Mg的金属活动性比M强,即Mg>M;则M、Mg、Cu的金属活动性由强到弱的顺序是Mg>M>Cu。
2. [25·廊坊广阳区二模]将未打磨的铝片放入试管中,逐滴加入过量稀盐酸,反应过程中产生氢气的质量与时间的关系如图所示,下列说法错误的是(
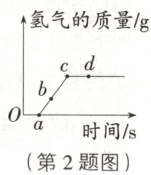
A.在 $ O \sim a $ 段,氧化铝和稀盐酸发生了反应
B.$ b $ 点时,观察到的现象是有气泡产生
C.只在 $ a \sim c $ 段生成了氯化铝
D.$ d $ 点时,向试管中滴加紫色石蕊溶液,溶液变红
C
)
A.在 $ O \sim a $ 段,氧化铝和稀盐酸发生了反应
B.$ b $ 点时,观察到的现象是有气泡产生
C.只在 $ a \sim c $ 段生成了氯化铝
D.$ d $ 点时,向试管中滴加紫色石蕊溶液,溶液变红
答案:
C 提示:未打磨的铝片表面有一层氧化铝薄膜,氧化铝先与稀盐酸反应生成氯化铝和水,氧化铝完全反应后,铝再与稀盐酸反应生成氯化铝和氢气,因此在0~c段都生成了氯化铝,故C项错误。
3. 我国古书上记载了很多有关金属的内容。
(1)[科粤九下 P15,T5(5)改编]西汉时期《淮南万毕术》中记载了“曾青(硫酸铜)涂铁,铁则化为铜”,成为现代湿法冶金的先驱。写出上述过程中发生反应的化学方程式:
(2)向 $ AgNO_3 $、$ Cu(NO_3)_2 $、$ Mg(NO_3)_2 $ 的混合溶液中加入一定质量的 Zn,充分反应后过滤,得到滤渣 A 和滤液 B。
①若反应前后溶液质量不变,滤渣 A 中一定含有
②若向滤液 B 中滴加稀盐酸,无明显现象,则滤液 B 中一定含有的金属离子是
(1)[科粤九下 P15,T5(5)改编]西汉时期《淮南万毕术》中记载了“曾青(硫酸铜)涂铁,铁则化为铜”,成为现代湿法冶金的先驱。写出上述过程中发生反应的化学方程式:
Fe+CuSO₄=FeSO₄+Cu
;说明铁的金属活动性比铜强
(选填“强”或“弱”)。(2)向 $ AgNO_3 $、$ Cu(NO_3)_2 $、$ Mg(NO_3)_2 $ 的混合溶液中加入一定质量的 Zn,充分反应后过滤,得到滤渣 A 和滤液 B。
①若反应前后溶液质量不变,滤渣 A 中一定含有
Cu、Ag
。②若向滤液 B 中滴加稀盐酸,无明显现象,则滤液 B 中一定含有的金属离子是
Mg²⁺、Zn²⁺
。
答案:
(1)Fe+CuSO₄=FeSO₄+Cu 强
(2)①Cu、Ag ②Mg²⁺、Zn²⁺
提示:
(1)铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为Fe+CuSO₄=FeSO₄+Cu;铁能置换出硫酸铜中的铜,说明铁的金属活动性比铜强。
(2)四种金属活动性顺序为Mg>Zn>Cu>Ag,向AgNO₃、Cu(NO₃)₂、Mg(NO₃)₂的混合溶液中加入一定质量的Zn,Zn不能与Mg(NO₃)₂溶液反应,锌优先与AgNO₃反应生成硝酸锌和银,若AgNO₃反应完,还有锌粉,锌才能与Cu(NO₃)₂反应生成硝酸锌和铜。反应的化学方程式为Zn+2AgNO₃=Zn(NO₃)₂+2Ag,每65份质量的锌能置换出216份质量的银,反应后固体质量增大,反应后溶液质量减小,待硝酸银反应完全,锌与硝酸铜反应生成硝酸锌和铜,反应的化学方程式为Zn+Cu(NO₃)₂=Zn(NO₃)₂+Cu,每65份质量的锌能置换出64份质量的铜,反应后固体质量减小,则反应后溶液质量增大,充分反应后过滤,得到滤渣A和滤液B。①若反应前后溶液质量不变,说明上述两个反应均发生,则滤渣A中一定含有银、铜,可能含有锌。②若向滤液B中滴加稀盐酸,无现象,说明硝酸银反应完全,无法判断硝酸铜是否参与反应,则滤液B中一定含有硝酸锌、硝酸镁,一定含有的金属离子是Mg²⁺、Zn²⁺。
(1)Fe+CuSO₄=FeSO₄+Cu 强
(2)①Cu、Ag ②Mg²⁺、Zn²⁺
提示:
(1)铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为Fe+CuSO₄=FeSO₄+Cu;铁能置换出硫酸铜中的铜,说明铁的金属活动性比铜强。
(2)四种金属活动性顺序为Mg>Zn>Cu>Ag,向AgNO₃、Cu(NO₃)₂、Mg(NO₃)₂的混合溶液中加入一定质量的Zn,Zn不能与Mg(NO₃)₂溶液反应,锌优先与AgNO₃反应生成硝酸锌和银,若AgNO₃反应完,还有锌粉,锌才能与Cu(NO₃)₂反应生成硝酸锌和铜。反应的化学方程式为Zn+2AgNO₃=Zn(NO₃)₂+2Ag,每65份质量的锌能置换出216份质量的银,反应后固体质量增大,反应后溶液质量减小,待硝酸银反应完全,锌与硝酸铜反应生成硝酸锌和铜,反应的化学方程式为Zn+Cu(NO₃)₂=Zn(NO₃)₂+Cu,每65份质量的锌能置换出64份质量的铜,反应后固体质量减小,则反应后溶液质量增大,充分反应后过滤,得到滤渣A和滤液B。①若反应前后溶液质量不变,说明上述两个反应均发生,则滤渣A中一定含有银、铜,可能含有锌。②若向滤液B中滴加稀盐酸,无现象,说明硝酸银反应完全,无法判断硝酸铜是否参与反应,则滤液B中一定含有硝酸锌、硝酸镁,一定含有的金属离子是Mg²⁺、Zn²⁺。
4. [人九下 P26,T7 高仿]某化学兴趣小组的同学,为了比较金属 R 与铁、铜的金属活动性强弱,进行如下探究活动:
【进行猜想】对三种金属的活动性顺序做出如下猜想:
猜想一: $ R > Fe > Cu $;猜想二: $ Fe > R > Cu $;猜想三:
【实验验证】为了验证哪种猜想成立,进行如下实验:
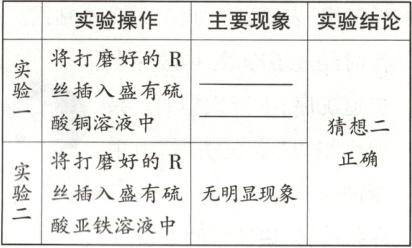
已知金属 R 在金属化合物的溶液中显 +3 价,写出 R 与硫酸铜溶液反应的化学方程式:
【进行猜想】对三种金属的活动性顺序做出如下猜想:
猜想一: $ R > Fe > Cu $;猜想二: $ Fe > R > Cu $;猜想三:
Fe>Cu>R
。【实验验证】为了验证哪种猜想成立,进行如下实验:

已知金属 R 在金属化合物的溶液中显 +3 价,写出 R 与硫酸铜溶液反应的化学方程式:
2R+3CuSO₄=R₂(SO₄)₃+3Cu
。
答案:
【进行猜想】Fe>Cu>R
【实验验证】R丝的表面有红色物质生成 2R+3CuSO₄=R₂(SO₄)₃+3Cu
提示:【进行猜想】由于铁、铜的活动性顺序已知,故金属R的活动性是位于铁的前面或两者之间或铜的后面。【实验验证】根据实验结论猜想二正确,即金属活动性Fe>R>Cu,则R能置换出硫酸铜中的铜,所以将打磨好的R丝插入盛有硫酸铜溶液中,观察到R丝的表面有红色物质生成。已知金属R在金属化合物的溶液中显+3价,R与硫酸铜反应的化学方程式为2R+3CuSO₄=R₂(SO₄)₃+3Cu。
【实验验证】R丝的表面有红色物质生成 2R+3CuSO₄=R₂(SO₄)₃+3Cu
提示:【进行猜想】由于铁、铜的活动性顺序已知,故金属R的活动性是位于铁的前面或两者之间或铜的后面。【实验验证】根据实验结论猜想二正确,即金属活动性Fe>R>Cu,则R能置换出硫酸铜中的铜,所以将打磨好的R丝插入盛有硫酸铜溶液中,观察到R丝的表面有红色物质生成。已知金属R在金属化合物的溶液中显+3价,R与硫酸铜反应的化学方程式为2R+3CuSO₄=R₂(SO₄)₃+3Cu。
5. 数字化实验将镁条和稀盐酸先后加入如图 1 所示的装置中(装置气密性良好),用压强传感器测得密闭容器内压强与时间的关系如图 2 所示。下列说法正确的是(
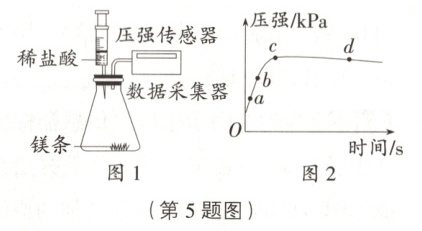
A.刚注入盐酸瞬间压强迅速上升是因为产生大量 $ H_2 $
B.$ bc $ 段反应速率比 $ ab $ 段反应速率快
C.$ cd $ 段压强减小是因为温度降低
D.$ a $ 点和 $ c $ 点溶液中的溶质均只有 $ MgCl_2 $
C
)
A.刚注入盐酸瞬间压强迅速上升是因为产生大量 $ H_2 $
B.$ bc $ 段反应速率比 $ ab $ 段反应速率快
C.$ cd $ 段压强减小是因为温度降低
D.$ a $ 点和 $ c $ 点溶液中的溶质均只有 $ MgCl_2 $
答案:
C 提示:刚注入盐酸瞬间压强迅速上升,是因为一开始将盐酸快速注入后,内部气体体积变小,造成压强增大,故A项错误;bc段曲线的斜率比ab段小,bc段反应速率比ab段反应速率慢,故B项错误;a点时稀盐酸有剩余,溶液中的溶质是氯化镁和氯化氢,c点恰好完全反应,溶液中的溶质是氯化镁,故D项错误。
查看更多完整答案,请扫码查看


