第83页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
4. 用如图所示装置进行实验,相关分析或结论正确的是(
A.黑色粉末减少说明反应开始
B.实验结束应立即倒出试管中的粉末
C.反应中铜元素在固体中的质量分数逐渐变大
D.固体减少的质量一定等于生成二氧化碳的质量
C
)A.黑色粉末减少说明反应开始
B.实验结束应立即倒出试管中的粉末
C.反应中铜元素在固体中的质量分数逐渐变大
D.固体减少的质量一定等于生成二氧化碳的质量
答案:
C
5. 在实验室进行“木炭还原氧化铜”的实验,下列相关图像,比较符合事实的是(
B
)
答案:
B 解析:高温条件下木炭和氧化铜反应生成铜和二氧化碳,完全反应后二氧化碳质量不再变化;随着反应进行,固体质量减小,完全反应后固体质量不再变化;反应过程中铜元素质量始终不变;随着反应进行,氧化铜质量减小。
6. 取木炭和氧化铜的混合物a g在一定条件下恰好完全反应,相关量的变化如图,下列说法正确的是(
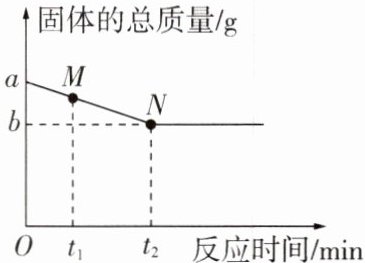
A.M点对应的固体物质只有两种
B.N点对应的固体为黑色
C.反应后产生气体的总质量为(a - b)g
$D.0~t_2min$内,固体中铜元素的质量分数不变
C
)
A.M点对应的固体物质只有两种
B.N点对应的固体为黑色
C.反应后产生气体的总质量为(a - b)g
$D.0~t_2min$内,固体中铜元素的质量分数不变
答案:
C 解析:木炭与氧化铜在高温条件下生成铜和二氧化碳,随着反应的进行,固体的总质量逐渐减少,至完全反应不再发生改变,至 N 点恰好完全反应,则 M 点对应的固体物质有木炭、氧化铜、铜三种,A 错误;N 点对应的固体为铜,为红色,B 错误;木炭与氧化铜在高温条件下生成铜和二氧化碳,由质量守恒定律可知,反应后产生气体的总质量为$(a-b)\unit{g}$,C 正确;反应前后铜元素的质量不变,但固体的质量逐渐减小,$0\sim t_{2}\min$内,固体中铜元素的质量分数增大,D 错误。
7. 有如图所示变化:

(1)写出有关物质的化学式:
B
D
(2)写出以上各步反应的化学方程式:
①
②
③

(1)写出有关物质的化学式:
B
${Cu}$
; C${CO_{2}}$
;D
${CuO}$
; E${CO}$
。(2)写出以上各步反应的化学方程式:
①
${C + 2CuO\xlongequal{高温}2Cu + CO_{2}\uparrow}$
;②
${2Cu + O_{2}\xlongequal{\Delta}2CuO}$
;③
${C + CO_{2}\xlongequal{高温}2CO}$
。
答案:
(1)${Cu}$ ${CO_{2}}$ ${CuO}$ ${CO}$
(2)①${C + 2CuO\xlongequal{\text{高温}}2Cu + CO_{2}\uparrow}$ ②${2Cu + O_{2}\xlongequal{\Delta}2CuO}$ ③${C + CO_{2}\xlongequal{\text{高温}}2CO}$
(1)${Cu}$ ${CO_{2}}$ ${CuO}$ ${CO}$
(2)①${C + 2CuO\xlongequal{\text{高温}}2Cu + CO_{2}\uparrow}$ ②${2Cu + O_{2}\xlongequal{\Delta}2CuO}$ ③${C + CO_{2}\xlongequal{\text{高温}}2CO}$
8. 科学探究与实践我国劳动人民早在五千年前就会使用木炭炼铜,在化学实验室里模拟炼铜,既可用传统的实验装置(图甲),又可用改进的微型实验装置(图乙)。化学兴趣小组同学采用图乙微型实验装置(其中长柄V形玻璃管用小玻璃管制成),开展以下探究活动。
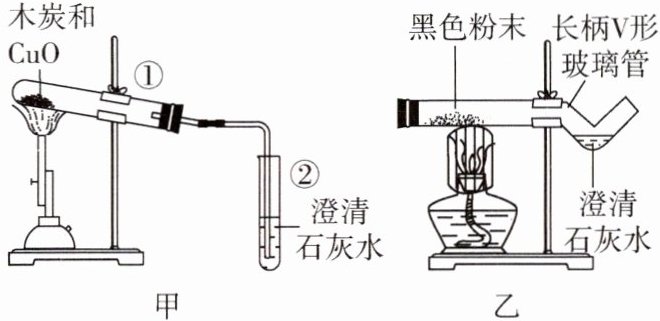
(1)图甲试管①中观察到的现象是
(2)判断木炭与氧化铜已经发生反应的依据是
(3)使用图乙装置与使用图甲装置相比,其优点是
(4)用甲装置进行实验,完毕后先停止加热,可能引起的后果是
(5)停止加热时,应先将导管从盛有澄清石灰水的试管中撤出,并用弹簧夹夹紧橡皮管,待硬质玻璃管冷却后再把试管里的粉末倒出。这样操作的原因是
(6)化学兴趣小组同学在实验室把18g木炭和氧化铜的混合物用酒精喷灯加热使之充分反应,冷却后称量固体剩余物为13.6g,假设该过程只有木炭和氧化铜发生反应,求参加反应的CuO的质量。

(1)图甲试管①中观察到的现象是
黑色固体变为红色固体
,反应的化学方程式为${2CuO + C\xlongequal{高温}2Cu + CO_{2}\uparrow}$
。(2)判断木炭与氧化铜已经发生反应的依据是
澄清石灰水开始变浑浊
。(3)使用图乙装置与使用图甲装置相比,其优点是
操作简单(或现象明显、节约试剂、反应条件容易达到、反应速率快等,合理即可)
(写出一条即可)。在酒精灯上加网罩的目的是集中火焰,提高温度
。(4)用甲装置进行实验,完毕后先停止加热,可能引起的后果是
液体倒流,引起试管炸裂
。(5)停止加热时,应先将导管从盛有澄清石灰水的试管中撤出,并用弹簧夹夹紧橡皮管,待硬质玻璃管冷却后再把试管里的粉末倒出。这样操作的原因是
防止灼热的铜被重新氧化
。(6)化学兴趣小组同学在实验室把18g木炭和氧化铜的混合物用酒精喷灯加热使之充分反应,冷却后称量固体剩余物为13.6g,假设该过程只有木炭和氧化铜发生反应,求参加反应的CuO的质量。
反应生成二氧化碳的质量为$\quantity{18}{g}-\quantity{13.6}{g}=\quantity{4.4}{g}$,设参加反应的${CuO}$的质量为$x$。${2CuO + C\xlongequal{高温}2Cu + CO_{2}\uparrow}$ 160 44 $x$ $\quantity{4.4}{g}$ $\dfrac{160}{44}=\dfrac{x}{\quantity{4.4}{g}}$ $x=\quantity{16}{g}$ 答:参加反应的${CuO}$的质量为$\quantity{16}{g}$。
答案:
(1)黑色固体变为红色固体 ${2CuO + C\xlongequal{\text{高温}}2Cu + CO_{2}\uparrow}$
(2)澄清石灰水开始变浑浊
(3)操作简单(或现象明显、节约试剂、反应条件容易达到、反应速率快等,合理即可) 集中火焰,提高温度
(4)液体倒流,引起试管炸裂
(5)防止灼热的铜被重新氧化
(6)反应生成二氧化碳的质量为$\quantity{18}{g}-\quantity{13.6}{g}=\quantity{4.4}{g}$,设参加反应的${CuO}$的质量为$x$。${2CuO + C\xlongequal{\text{高温}}2Cu + CO_{2}\uparrow}$ 160 44 $x$ $\quantity{4.4}{g}$ $\dfrac{160}{44}=\dfrac{x}{\quantity{4.4}{g}}$ $x=\quantity{16}{g}$ 答:参加反应的${CuO}$的质量为$\quantity{16}{g}$。
(1)黑色固体变为红色固体 ${2CuO + C\xlongequal{\text{高温}}2Cu + CO_{2}\uparrow}$
(2)澄清石灰水开始变浑浊
(3)操作简单(或现象明显、节约试剂、反应条件容易达到、反应速率快等,合理即可) 集中火焰,提高温度
(4)液体倒流,引起试管炸裂
(5)防止灼热的铜被重新氧化
(6)反应生成二氧化碳的质量为$\quantity{18}{g}-\quantity{13.6}{g}=\quantity{4.4}{g}$,设参加反应的${CuO}$的质量为$x$。${2CuO + C\xlongequal{\text{高温}}2Cu + CO_{2}\uparrow}$ 160 44 $x$ $\quantity{4.4}{g}$ $\dfrac{160}{44}=\dfrac{x}{\quantity{4.4}{g}}$ $x=\quantity{16}{g}$ 答:参加反应的${CuO}$的质量为$\quantity{16}{g}$。
查看更多完整答案,请扫码查看


