第92页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
8. (2024·广元中考)乙醇$(C_2H_5OH)$是常用的燃料。现有4.6g乙醇与一定量氧气混合于密闭容器内,在一定条件下反应物全部转化为一氧化碳、二氧化碳和水,恢复到室温,测得所得气体中氧元素质量分数为70%,则参加反应的氧气质量为 (
A.6.4g
B.8.0g
C.8.8g
D.9.6g
C
)A.6.4g
B.8.0g
C.8.8g
D.9.6g
答案:
C 解析:现有 4.6g 乙醇与一定量氧气混合于密闭容器内,在一定条件下反应物全部转化为一氧化碳、二氧化碳和水,4.6g 乙醇 $(C_{2}H_{5}OH)$ 中碳元素的质量为 $4.6g×\frac{12×2}{12×2 + 1×6 + 16}×100\% = 2.4g$,氢元素的质量为 $4.6g×\frac{1×6}{12×2 + 1×6 + 16}×100\% = 0.6g$,恢复到室温所得气体是一氧化碳和二氧化碳的混合物,其中氧元素质量分数为 70%,则碳元素的质量分数为 $1 - 70\% = 30\%$,所以混合气体的质量为 $2.4g÷30\% = 8g$,乙醇燃烧生成水的质量为 $0.6g÷(\frac{1×2}{1×2 + 16}×100\%) = 5.4g$,根据质量守恒定律可知,参加反应的氧气的质量为 $(8g + 5.4g) - 4.6g = 8.8g$,故选 C。
9. 某密闭容器中只有乙、丙、丁三种物质,在一定条件下发生了一个化学反应,容器中乙、丙、丁的质量随甲的质量变化情况如图所示。下列说法错误的是 (
A.a的值为12
B.丁属于化合物
C.当丁为5g时,容器中乙的质量为11g
D.当甲为2g时,容器中丙与丁的质量之比为12:5
D
)A.a的值为12
B.丁属于化合物
C.当丁为5g时,容器中乙的质量为11g
D.当甲为2g时,容器中丙与丁的质量之比为12:5
答案:
D 解析:根据质量守恒定律可知,反应前后物质的总质量不变,所以 $10g + 6g + 10g = 8g + ag + 6g$,a 的值为 12,A 选项正确;反应后质量增加的是生成物,甲的质量增加 8g,是生成物;丁的质量减少 10g,是反应物,乙的质量增加 2g,是生成物,反应的表达式为丁→甲 + 乙,故丁属于化合物,B 选项正确;由上述分析可知,乙和丁的质量变化量之比为 $1:5$,当丁为 5g 时,反应掉的丁为 5g,容器中乙的质量增加 1g,乙的总质量为 11g,C 选项正确;甲和丁的质量变化量之比为 $4:5$,当甲为 2g 时,反应掉丁的质量为 2.5g,剩余丁的质量为 7.5g,容器中丙与丁的质量之比为 $6g:7.5g = 4:5$,D 选项错误。
10. 工业上用NO生产$HNO_3$过程中的物质转化关系如图。下列说法正确的是 (

A.转化过程中,氮、氢、氧元素的化合价均发生了变化
B.反应①中,参加反应的NO与$O_2$的分子数之比为1:2
C.反应②中,参加反应的$NO_2$与生成的$HNO_3$含有等质量的氮元素
D.当$O_2、$$H_2O$足量时,30gNO理论上最多生成$63gHNO_3$
D
)
A.转化过程中,氮、氢、氧元素的化合价均发生了变化
B.反应①中,参加反应的NO与$O_2$的分子数之比为1:2
C.反应②中,参加反应的$NO_2$与生成的$HNO_3$含有等质量的氮元素
D.当$O_2、$$H_2O$足量时,30gNO理论上最多生成$63gHNO_3$
答案:
D 解析:硝酸和水中氢元素的化合价均为 +1 价,化合价没有改变,A 错误;反应①为 NO 和 $O_{2}$ 反应生成 $NO_{2}$,反应的化学方程式为 $2NO + O_{2} = 2NO_{2}$,则参加反应的 NO 与 $O_{2}$ 的分子数之比为 $2:1$,B 错误;由图可知,反应②为二氧化氮和水反应生成一氧化氮和硝酸,根据反应前后氮元素质量不变,则二氧化氮中氮元素的质量等于硝酸中氮元素的质量和一氧化氮中氮元素的质量之和,C 错误;当氧气和水足量时,若一氧化氮完全转化为硝酸,设生成硝酸的质量为 x,则:
$NO\sim HNO_{3}$
30 63
30g x
$\frac{30}{63}=\frac{30g}{x}$
解得 $x = 63g$,则 30g NO 理论上最多生成 63g $HNO_{3}$,D 正确。
$NO\sim HNO_{3}$
30 63
30g x
$\frac{30}{63}=\frac{30g}{x}$
解得 $x = 63g$,则 30g NO 理论上最多生成 63g $HNO_{3}$,D 正确。
11. (2025·镇江期中)已知$:NaOH+CO_2→Na_2CO_3+H_2O。$向含有4.0gNaOH的水溶液中通入一定量$CO_2,NaOH$全部转化为$m_1gNa_2CO_3;$继续通入一定量$CO_2,Na_2CO_3$全部转化为$m_2gNaHCO_3。$下列说法正确的是 (
D
)
答案:
D 解析:根据质量守恒定律,反应前后元素的质量不变,则 NaOH 中钠元素的质量 = 生成物碳酸钠中钠元素的质量,则碳酸钠的质量 $m_{1}g = 4.0g×(\frac{23}{40}×100\%)÷(\frac{23×2}{106}×100\%) = 5.3g$,即 $m_{1} = 5.3$,A 错误;根据质量守恒定律,反应前后元素的种类不变,碳酸氢钠中含有钠、碳、氢、氧元素,二氧化碳中含有碳、氧元素,碳酸钠中含有钠、碳、氧元素,则还缺少含有氢元素的物质,即溶液中的水也参与反应,则第二次通入 $CO_{2}$ 发生的反应为碳酸钠与水和二氧化碳反应生成碳酸氢钠,反应的符号表达式为 $Na_{2}CO_{3}+H_{2}O + CO_{2}\to NaHCO_{3}$,B 错误;碳酸钠全部转化为碳酸氢钠,根据质量守恒定律,反应前后元素的质量不变,则碳酸氢钠的质量 $m_{2}g = 5.3g×(\frac{23×2}{106}×100\%)÷(\frac{23}{84}×100\%) = 8.4g$,则 $m_{1}\lt m_{2}$,C 错误;根据质量守恒定律,反应前后元素的质量不变,则第一次参加反应的二氧化碳的质量为 $5.3g×(\frac{12}{106}×100\%)÷(\frac{12}{44}×100\%) = 2.2g$;设第二次参加反应的二氧化碳的质量为 x,则
$Na_{2}CO_{3}+H_{2}O + CO_{2} = 2NaHCO_{3}$
106 44
5.3g x
$\frac{106}{44}=\frac{5.3g}{x}$, $x = 2.2g$,
即两次参加反应的 $CO_{2}$ 的质量相等,D 正确。
$Na_{2}CO_{3}+H_{2}O + CO_{2} = 2NaHCO_{3}$
106 44
5.3g x
$\frac{106}{44}=\frac{5.3g}{x}$, $x = 2.2g$,
即两次参加反应的 $CO_{2}$ 的质量相等,D 正确。
12. (2024·淮安模拟)草酸亚铁$(FeC_2O_4)$常用于生产锂电池,它在不同温度下分解能得到不同的铁的氧化物,同时放出气体$,43.2gFeC_2O_4$受热分解所得固体质量随温度变化如图所示,下列说法正确的是 (
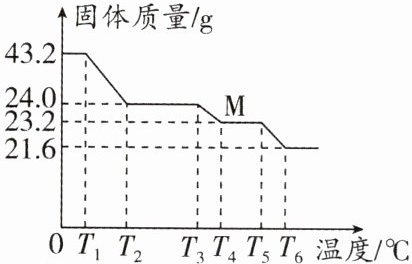
$A.FeC_2O_4$由铁原子、碳原子、氧原子直接构成
B.根据数据可推出固体M的化学式为$Fe_3O_4$
$C.T_4℃$时,固体M开始分解
D.固体质量由43.2g变为24.0g时的化学方程式为$FeC_2O_4\xlongequal{\triangle}FeCO_3+CO↑$
B
)
$A.FeC_2O_4$由铁原子、碳原子、氧原子直接构成
B.根据数据可推出固体M的化学式为$Fe_3O_4$
$C.T_4℃$时,固体M开始分解
D.固体质量由43.2g变为24.0g时的化学方程式为$FeC_2O_4\xlongequal{\triangle}FeCO_3+CO↑$
答案:
B 解析:根据 $FeC_{2}O_{4}$ 化学式可知,$FeC_{2}O_{4}$ 由亚铁离子和草酸根离子构成,A 错误;由图可知,生成 M 的质量为 23.2g,根据质量守恒定律,化学反应前后,元素的种类和质量不变,则 M 中铁元素的质量与草酸亚铁中铁元素的质量相同,则铁元素的质量为 $43.2g×\frac{56}{56 + 12×2 + 16×4}×100\% = 16.8g$,则 M 中氧元素的质量 = $23.2g - 16.8g = 6.4g$,设 M 的化学式为 $Fe_{a}O_{b}$,则 $56a:16b = 16.8g:6.4g$, $a:b = 3:4$,故 M 的化学式为 $Fe_{3}O_{4}$,B 正确;根据图示可知,$T_{5}^{\circ}C$ 时,固体 M 开始分解,C 错误;固体质量由 43.2g 变为 24.0g 时,若按 $FeC_{2}O_{4}\xlongequal{\triangle}FeCO_{3}+CO\uparrow$ 方式进行,设反应过程中生成 $FeCO_{3}$ 的质量为 x。
$FeC_{2}O_{4}\xlongequal{\triangle}FeCO_{3}+CO\uparrow$
144 116
43.2g x
$\frac{144}{116}=\frac{43.2g}{x}$ $x = 34.8g\neq24.0g$,D 错误。
$FeC_{2}O_{4}\xlongequal{\triangle}FeCO_{3}+CO\uparrow$
144 116
43.2g x
$\frac{144}{116}=\frac{43.2g}{x}$ $x = 34.8g\neq24.0g$,D 错误。
13. (10分)(2025·苏州期中)海水是宝贵的自然资源,从海水中可获得许多用途广泛的物质。部分海水资源的利用如图1所示。
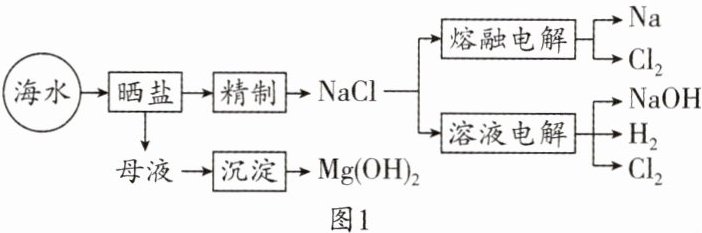
(1)海水晒盐得到的母液中含有氯化镁,其含有的阳离子是
(2)生成的$Mg(OH)_2$在加热条件下会分解生成MgO和另一种常见的氧化物,该反应的化学方程式为
(3)电解饱和NaCl溶液得到氯气和氢气$,H_2$在$Cl_2$中燃烧的微观粒子示意图如图2所示。
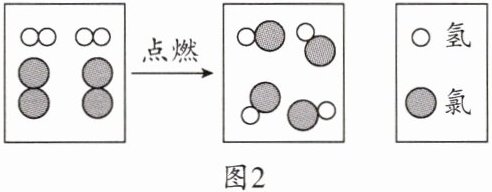
该反应的化学方程式为
(4)在上述从海水中获得的物质中,属于非金属单质的物质有
(5)工业上为得到23t的金属钠,理论上需要电解熔融的氯化钠的质量为

(1)海水晒盐得到的母液中含有氯化镁,其含有的阳离子是
$Mg^{2+}$
(填离子符号)。(2)生成的$Mg(OH)_2$在加热条件下会分解生成MgO和另一种常见的氧化物,该反应的化学方程式为
$Mg(OH)_{2}\xlongequal{\triangle}MgO + H_{2}O$
。(3)电解饱和NaCl溶液得到氯气和氢气$,H_2$在$Cl_2$中燃烧的微观粒子示意图如图2所示。

该反应的化学方程式为
$H_{2}+Cl_{2}\xlongequal{点燃}2HCl$
。(4)在上述从海水中获得的物质中,属于非金属单质的物质有
$H_{2}$、$Cl_{2}$
(填化学式)。(5)工业上为得到23t的金属钠,理论上需要电解熔融的氯化钠的质量为
58.5t
。(假设氯化钠中的钠元素全部转化为金属钠)
答案:
(1)$Mg^{2+}$
(2)$Mg(OH)_{2}\xlongequal{\triangle}MgO + H_{2}O$
(3)$H_{2}+Cl_{2}\xlongequal{点燃}2HCl$
(4)$H_{2}$、$Cl_{2}$
(5)58.5t
(1)$Mg^{2+}$
(2)$Mg(OH)_{2}\xlongequal{\triangle}MgO + H_{2}O$
(3)$H_{2}+Cl_{2}\xlongequal{点燃}2HCl$
(4)$H_{2}$、$Cl_{2}$
(5)58.5t
查看更多完整答案,请扫码查看


