第106页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
8. 甲、乙、丙是某同学设计的三套制取二氧化碳的发生装置,对三套装置分析不正确的是 (
A.甲装置此时容器内右侧大气压大于外界大气压
B.此时甲装置中的止水夹M处于打开状态
C.乙装置N处添加止水夹可以与甲装置具有相同功能
D.丙装置具有可控制反应进行或停止的功能
B
)A.甲装置此时容器内右侧大气压大于外界大气压
B.此时甲装置中的止水夹M处于打开状态
C.乙装置N处添加止水夹可以与甲装置具有相同功能
D.丙装置具有可控制反应进行或停止的功能
答案:
B 解析:根据图示可知,左侧液面高于右侧液面,说明右侧压强大于外界大气压,A正确;此时甲装置中固体与液体分离,说明止水夹M处于关闭状态,B不正确;乙装置N处添加止水夹与甲装置具有相同的功能,关闭止水夹,装置内压强增大,固液分离,能使反应停止,打开止水夹,固液接触,反应发生,C正确;丙装置可以通过粗铜丝控制石灰石与稀盐酸接触或脱离,可以控制反应的发生或停止,D正确。
9. 某兴趣小组设计如图所示装置,测定石灰石中碳酸钙的质量。下列说法不正确的是 (
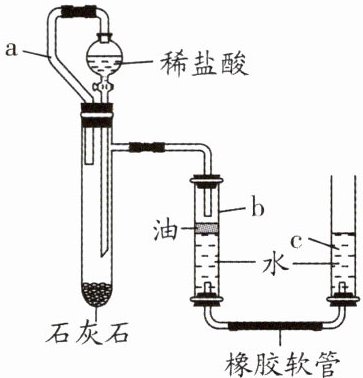
A.检查装置的气密性时,应先将a管用止水夹夹紧,再上下移动c管
B.不能用稀硫酸代替盐酸
C.反应产生的二氧化碳使得b管内压强增大
D.a管的作用是平衡试管和分液漏斗内压强
A
)
A.检查装置的气密性时,应先将a管用止水夹夹紧,再上下移动c管
B.不能用稀硫酸代替盐酸
C.反应产生的二氧化碳使得b管内压强增大
D.a管的作用是平衡试管和分液漏斗内压强
答案:
A 解析:检查装置的气密性时,不能夹紧a管,只需上下移动c管,导致左侧装置内气压和外界大气压不同,观察b、c管中是否有稳定的液面差,如形成的液面差稳定,则说明左侧装置和外界不连通,装置气密性良好,A错误;因为稀硫酸和碳酸钙反应生成的硫酸钙微溶于水,覆盖在石灰石表面,阻止反应的进行,所以不能用稀硫酸代替盐酸,B正确;石灰石的主要成分是碳酸钙,碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,反应产生的二氧化碳进入b管,使得b管内压强增大,C正确;a导管可以平衡试管和分液漏斗内压强,使分液漏斗内气压和试管内气压相同,便于液体流下,D正确。
10. 实验室制备并收集二氧化碳,按下表进行实验,取等质量的同种大理石加入足量酸中(杂质不与酸反应),产生二氧化碳气体体积随时间变化曲线如图所示,下列说法错误的是 (

A.实验Ⅲ对应的如图变化曲线为甲
B.实验Ⅱ和Ⅲ对比,说明影响反应速率的因素是固体的颗粒大小
C.实验Ⅰ和Ⅱ对比,说明影响反应速率的因素是酸的浓度
D.实验Ⅱ和Ⅲ完全反应后,产生二氧化碳的质量是相等的
C
)
A.实验Ⅲ对应的如图变化曲线为甲
B.实验Ⅱ和Ⅲ对比,说明影响反应速率的因素是固体的颗粒大小
C.实验Ⅰ和Ⅱ对比,说明影响反应速率的因素是酸的浓度
D.实验Ⅱ和Ⅲ完全反应后,产生二氧化碳的质量是相等的
答案:
C 解析:大理石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳。实验Ⅲ中的大理石是粉末状的,反应速率最快,所以实验Ⅲ对应的变化曲线为甲,A正确;实验Ⅱ和Ⅲ中选择的酸都是7% HCl溶液,Ⅱ中是块状大理石,Ⅲ中是大理石粉末,实验Ⅱ和Ⅲ对比,说明影响反应速率的因素是固体的颗粒大小,B正确;实验Ⅰ和Ⅱ中所用酸的种类和浓度都不同,没有可比性,C错误;由题意和图像可知,实验Ⅱ和Ⅲ完全反应后,产生二氧化碳的质量是相等的,D正确。
11. 新趋势 数字化实验 (2024·武汉期末)兴趣小组在实验室制取$CO_{2}$的发生装置中连接压强传感器,如图1,测得实验过程中试管内气体压强变化情况如图2。下列说法不正确的是 (
A.ab段长颈漏斗中液面逐渐上升
B.bc段反应物固体与液体脱离接触
C.c点的对应操作是打开弹簧夹
D.该发生装置可以控制反应速率,得到平稳的气流
D
)A.ab段长颈漏斗中液面逐渐上升
B.bc段反应物固体与液体脱离接触
C.c点的对应操作是打开弹簧夹
D.该发生装置可以控制反应速率,得到平稳的气流
答案:
D 解析:ab段压强增大,说明装置内气体增多,此时弹簧夹关闭,压强增大,将液体压回长颈漏斗,漏斗中液面逐渐上升,A正确;bc段压强不变,说明反应停止,且装置密闭,说明石灰石与盐酸脱离接触,B正确;c点之后压强减小,气体导出,说明此时打开弹簧夹,C正确;该发生装置可以通过压强控制反应发生和停止,但不能控制反应速率得到平稳的气流,D错误。
12. (2025·鞍山期中)某校化学活动小组探究气体的测定和数据处理方法。
【提出问题】如何利用石灰石与稀盐酸来测定生成$CO_{2}$的质量和体积,并处理数据。
【实验设计】通过下列两个实验分别测定$CO_{2}$的质量和体积:
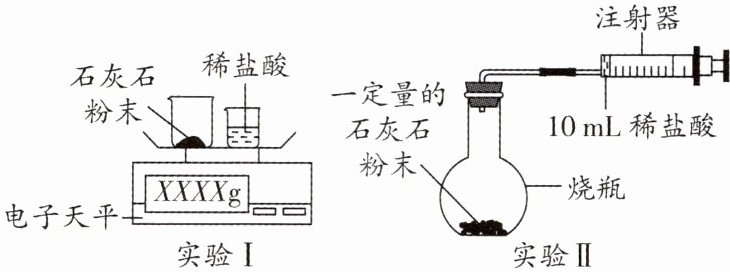
【分析与表达】
(1)上述两个实验中,反应的化学方程式为
(2)实验Ⅰ中,将小烧杯中的所有稀盐酸分几次加入大烧杯中,并不断搅拌,判断石灰石中$CaCO_{3}$完全反应的实验现象是
(3)实验Ⅱ中,先连接好装置,再检查装置的气密性,请简述方法
【记录与处理】
(4)①已知实验Ⅰ反应前的总质量[$m$(大烧杯+石灰石粉末)+$m$(小烧杯+稀盐酸)],要计算生成$CO_{2}$的质量,至少还需要的数据是
A. $m$(小烧杯)
B. $m$(大烧杯)
C. $m$(大烧杯+反应后剩余物)
②若求得生成$CO_{2}$的质量为4.4g,则参加反应的$CaCO_{3}$的质量为
(5)实验Ⅱ的实验记录如表(表中数据在相同温度、相同压强条件下测定):
据以上实验过程和实验数据综合分析,最终生成$CO_{2}$的体积是
【反思与评价】
(6)经过分析,你认为这两种方法的特点分别是:实验Ⅰ
【提出问题】如何利用石灰石与稀盐酸来测定生成$CO_{2}$的质量和体积,并处理数据。
【实验设计】通过下列两个实验分别测定$CO_{2}$的质量和体积:

【分析与表达】
(1)上述两个实验中,反应的化学方程式为
${CaCO_{3} + 2HCl = CaCl_{2} + CO_{2}\uparrow + H_{2}O}$
。(2)实验Ⅰ中,将小烧杯中的所有稀盐酸分几次加入大烧杯中,并不断搅拌,判断石灰石中$CaCO_{3}$完全反应的实验现象是
最后一次加入稀盐酸,仍没有气泡产生
。(3)实验Ⅱ中,先连接好装置,再检查装置的气密性,请简述方法
将注射器往右拉,松开后活塞回到之前的刻度,则气密性良好
,然后装好试剂,最后将10mL稀盐酸快速推入烧瓶中,若稀盐酸是缓慢推入的,则可能造成的后果是烧瓶内气压增大,稀盐酸难以完全推入烧瓶中(或仪器连接处脱落)
。【记录与处理】
(4)①已知实验Ⅰ反应前的总质量[$m$(大烧杯+石灰石粉末)+$m$(小烧杯+稀盐酸)],要计算生成$CO_{2}$的质量,至少还需要的数据是
AC
(填字母)。A. $m$(小烧杯)
B. $m$(大烧杯)
C. $m$(大烧杯+反应后剩余物)
②若求得生成$CO_{2}$的质量为4.4g,则参加反应的$CaCO_{3}$的质量为
10
g。(5)实验Ⅱ的实验记录如表(表中数据在相同温度、相同压强条件下测定):
据以上实验过程和实验数据综合分析,最终生成$CO_{2}$的体积是
80
mL。【反思与评价】
(6)经过分析,你认为这两种方法的特点分别是:实验Ⅰ
巧妙利用质量守恒定律测出气体的质量
,实验Ⅱ用十分简单的装置,利用前后气体体积差测得二氧化碳的体积
。
答案:
(1)${CaCO_{3} + 2HCl = CaCl_{2} + CO_{2}\uparrow + H_{2}O}$
(2)最后一次加入稀盐酸,仍没有气泡产生
(3)将注射器往右拉,松开后活塞回到之前的刻度,则气密性良好 烧瓶内气压增大,稀盐酸难以完全推入烧瓶中(或仪器连接处脱落)
(4)①AC ②10
(5)80
(6)巧妙利用质量守恒定律测出气体的质量 用十分简单的装置,利用前后气体体积差测得二氧化碳的体积 解析:
(3)随着液体的推入,烧瓶内的气体会被压缩,气压会变大,所以若稀盐酸是缓慢推入的,则可能造成的后果是烧瓶内气压增大,稀盐酸难以完全推入烧瓶中或仪器连接处脱落。
(4)①根据质量守恒定律,反应前后参加反应的各物质的总质量等于生成的各物质的总质量,所以需要知道反应后剩余物质的总质量和反应前反应物的总质量,减少的质量为生成二氧化碳的质量,已知反应前的总质量,则还需知道反应后剩余物的质量、大烧杯和小烧杯的质量,故选AC;
②设参加反应的碳酸钙的质量为x,则
${CaCO_{3} + 2HCl = CaCl_{2} + H_{2}O + CO_{2}\uparrow}$
100 44
x 4.4g
$\frac{100}{44} = \frac{x}{4.4g}$
解得x=10g
则参加反应的${CaCO_{3}}$的质量为10g。
(5)因为稀盐酸有10mL在注射器中,则反应后的注射器读数的体积为二氧化碳的体积+10mL,根据表格,8、9min时注射器读数都是90.0mL,则最终生成二氧化碳的体积为90.0mL-10mL=80mL。
(1)${CaCO_{3} + 2HCl = CaCl_{2} + CO_{2}\uparrow + H_{2}O}$
(2)最后一次加入稀盐酸,仍没有气泡产生
(3)将注射器往右拉,松开后活塞回到之前的刻度,则气密性良好 烧瓶内气压增大,稀盐酸难以完全推入烧瓶中(或仪器连接处脱落)
(4)①AC ②10
(5)80
(6)巧妙利用质量守恒定律测出气体的质量 用十分简单的装置,利用前后气体体积差测得二氧化碳的体积 解析:
(3)随着液体的推入,烧瓶内的气体会被压缩,气压会变大,所以若稀盐酸是缓慢推入的,则可能造成的后果是烧瓶内气压增大,稀盐酸难以完全推入烧瓶中或仪器连接处脱落。
(4)①根据质量守恒定律,反应前后参加反应的各物质的总质量等于生成的各物质的总质量,所以需要知道反应后剩余物质的总质量和反应前反应物的总质量,减少的质量为生成二氧化碳的质量,已知反应前的总质量,则还需知道反应后剩余物的质量、大烧杯和小烧杯的质量,故选AC;
②设参加反应的碳酸钙的质量为x,则
${CaCO_{3} + 2HCl = CaCl_{2} + H_{2}O + CO_{2}\uparrow}$
100 44
x 4.4g
$\frac{100}{44} = \frac{x}{4.4g}$
解得x=10g
则参加反应的${CaCO_{3}}$的质量为10g。
(5)因为稀盐酸有10mL在注射器中,则反应后的注射器读数的体积为二氧化碳的体积+10mL,根据表格,8、9min时注射器读数都是90.0mL,则最终生成二氧化碳的体积为90.0mL-10mL=80mL。
查看更多完整答案,请扫码查看


