第23页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
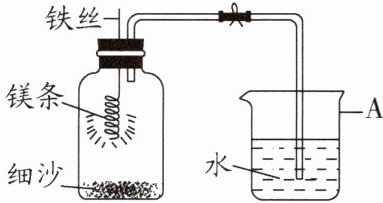
10. 某研究小组用如图所示装置探究能否用镁条代替红磷测定空气中氧气的含量。实验前,小组成员提出了不同的猜想。
【猜想与假设】
猜想 1:可以代替,因为镁条与氧气反应生成氧化镁,反应后不会产生气体;
猜想 2:不能代替,查阅资料知金属镁很活泼,可能会与空气中的氮气反应。
【进行实验】
|步骤|实验操作|实验现象|
|Ⅰ|组装好装置后,打开止水夹,手捂集气瓶,一段时间后松开手|烧杯中导管口有气泡冒出,松手后烧杯中导管末端有一段液柱|
|Ⅱ|关闭止水夹,点燃镁条,迅速伸入集气瓶中,塞好塞子|镁条燃烧,放出大量热,发出耀眼白光,生成大量白烟,剩余固体为白色带状物|
|Ⅲ|冷却至室温,打开止水夹|烧杯中水从导管进入集气瓶中,体积约为集气瓶容积的$\frac{2}{5}$|
【解释与结论】
(1)镁与氧气反应的文字表达式为
(2)步骤Ⅰ说明装置的气密性
(3)步骤Ⅱ中,关闭止水夹的目的是
(4)推测猜想 2 成立的现象证据是
【反思与评价】
(5)该小组认为,即使步骤Ⅲ中水的体积恰好占集气瓶容积的$\frac{1}{5},$也不能说明猜想 1 成立,理由是
(6)小组中同学对镁条与瓶中气体的反应提出了进一步的猜想:甲同学认为镁条先与 O₂反应,乙同学认为镁条先与 N₂反应。为检验他们的猜想,可以进行的实验操作是:取少量镁条,点燃后迅速放入盛有空气的集气瓶中,待镁条熄灭后,再将燃着的木条放入瓶中观察现象,若燃烧更旺说明

【猜想与假设】
猜想 1:可以代替,因为镁条与氧气反应生成氧化镁,反应后不会产生气体;
猜想 2:不能代替,查阅资料知金属镁很活泼,可能会与空气中的氮气反应。
【进行实验】
|步骤|实验操作|实验现象|
|Ⅰ|组装好装置后,打开止水夹,手捂集气瓶,一段时间后松开手|烧杯中导管口有气泡冒出,松手后烧杯中导管末端有一段液柱|
|Ⅱ|关闭止水夹,点燃镁条,迅速伸入集气瓶中,塞好塞子|镁条燃烧,放出大量热,发出耀眼白光,生成大量白烟,剩余固体为白色带状物|
|Ⅲ|冷却至室温,打开止水夹|烧杯中水从导管进入集气瓶中,体积约为集气瓶容积的$\frac{2}{5}$|
【解释与结论】
(1)镁与氧气反应的文字表达式为
镁+氧气$\xrightarrow{点燃}$氧化镁
。(2)步骤Ⅰ说明装置的气密性
良好
。(3)步骤Ⅱ中,关闭止水夹的目的是
防止温度升高导致气压增大,将部分气体压出集气瓶
。(4)推测猜想 2 成立的现象证据是
烧杯中水从导管进入集气瓶中,体积约为集气瓶容积的$\frac{2}{5}$
。【反思与评价】
(5)该小组认为,即使步骤Ⅲ中水的体积恰好占集气瓶容积的$\frac{1}{5},$也不能说明猜想 1 成立,理由是
Mg 的量不足(或其他合理原因)
。(6)小组中同学对镁条与瓶中气体的反应提出了进一步的猜想:甲同学认为镁条先与 O₂反应,乙同学认为镁条先与 N₂反应。为检验他们的猜想,可以进行的实验操作是:取少量镁条,点燃后迅速放入盛有空气的集气瓶中,待镁条熄灭后,再将燃着的木条放入瓶中观察现象,若燃烧更旺说明
乙
同学的猜想成立,若熄灭说明另一猜想成立。
答案:
10.
(1)镁+氧气$\xrightarrow{点燃}$氧化镁
(2)良好
(3)防止温度升高导致气压增大,将部分气体压出集气瓶
(4)烧杯中水从导管进入集气瓶中,体积约为集气瓶容积的$\frac{2}{5}$
(5)Mg 的量不足(或其他合理原因)
(6)乙 解析:
(2)步骤Ⅰ组装好装置后,打开止水夹,手捂集气瓶,一段时间后松开手,烧杯中导管口有气泡冒出,松手后烧杯中导管末端形成一段液柱,说明装置的气密性良好。
(3)步骤Ⅱ中,关闭止水夹的目的是防止温度升高导致气压增大,将部分气体压出集气瓶。
(4)因为氧气约占空气体积的$\frac{1}{5}$,所以在操作正确的情况下如果大于$\frac{1}{5}$,则氮气可能参加了反应,故推测猜想 2 成立的现象证据是:烧杯中水从导管进入集气瓶中,体积约为集气瓶容积的$\frac{2}{5}$。
(5)该小组认为,即使步骤Ⅲ中水的体积恰好占集气瓶容积的$\frac{1}{5}$,也不能说明猜想 1 成立,这是因为反应中未说明镁条的用量,镁条的量可能不足,没有将能反应的气体消耗完毕,使进入的水的体积偏少。
(6)为进一步检验他们的猜想(甲同学认为镁条先与$O_{2}$反应,乙同学认为镁条先与$N_{2}$反应),可以进行的实验操作是:取少量镁条,点燃后迅速放入盛有空气的集气瓶中,待镁条熄灭后,再将燃着的木条放入瓶中观察现象,若燃烧更旺说明乙同学的猜想成立,若熄灭说明甲同学的猜想成立。
(1)镁+氧气$\xrightarrow{点燃}$氧化镁
(2)良好
(3)防止温度升高导致气压增大,将部分气体压出集气瓶
(4)烧杯中水从导管进入集气瓶中,体积约为集气瓶容积的$\frac{2}{5}$
(5)Mg 的量不足(或其他合理原因)
(6)乙 解析:
(2)步骤Ⅰ组装好装置后,打开止水夹,手捂集气瓶,一段时间后松开手,烧杯中导管口有气泡冒出,松手后烧杯中导管末端形成一段液柱,说明装置的气密性良好。
(3)步骤Ⅱ中,关闭止水夹的目的是防止温度升高导致气压增大,将部分气体压出集气瓶。
(4)因为氧气约占空气体积的$\frac{1}{5}$,所以在操作正确的情况下如果大于$\frac{1}{5}$,则氮气可能参加了反应,故推测猜想 2 成立的现象证据是:烧杯中水从导管进入集气瓶中,体积约为集气瓶容积的$\frac{2}{5}$。
(5)该小组认为,即使步骤Ⅲ中水的体积恰好占集气瓶容积的$\frac{1}{5}$,也不能说明猜想 1 成立,这是因为反应中未说明镁条的用量,镁条的量可能不足,没有将能反应的气体消耗完毕,使进入的水的体积偏少。
(6)为进一步检验他们的猜想(甲同学认为镁条先与$O_{2}$反应,乙同学认为镁条先与$N_{2}$反应),可以进行的实验操作是:取少量镁条,点燃后迅速放入盛有空气的集气瓶中,待镁条熄灭后,再将燃着的木条放入瓶中观察现象,若燃烧更旺说明乙同学的猜想成立,若熄灭说明甲同学的猜想成立。
查看更多完整答案,请扫码查看


