第77页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
11. 新情境 (2024·扬州期中)某太阳能技术研究所利用太阳能聚光器获得高能量太阳能,以太阳能为热源,经由$ Fe_3O_4$循环分解水,其过程如图所示,下列有关说法正确的是(

A.使用$ Fe_3O_4,$可以提高$ H_2$的产量
B.反应Ⅱ中仅涉及 H 元素化合价的改变
C.整个循环过程中涉及的氧化物有 2 种
$D.Fe_3O_4$中氧元素的质量分数比 FeOₓ的大
D
)
A.使用$ Fe_3O_4,$可以提高$ H_2$的产量
B.反应Ⅱ中仅涉及 H 元素化合价的改变
C.整个循环过程中涉及的氧化物有 2 种
$D.Fe_3O_4$中氧元素的质量分数比 FeOₓ的大
答案:
D 解析:根据图示,以太阳能为热源,经由$Fe_{3}O_{4}$循环分解水,四氧化三铁起催化作用,只是改变反应的速率,不能提高氢气的产量,A错误;反应Ⅱ中是$FeO_{x}$和水反应产生四氧化三铁和氢气,氢气中氢元素化合价为零,水中H的化合价为+1价,$FeO_{x}$得到O发生氧化反应生成四氧化三铁,则铁元素的化合价有改变,故反应Ⅱ中涉及H、Fe元素化合价的改变,B错误;整个循环过程中涉及的氧化物有3种:$Fe_{3}O_{4}$、$FeO_{x}$、$H_{2}O$,C错误;根据图示,$Fe_{3}O_{4}$失去氧元素产生$FeO_{x}$,则四氧化三铁中O元素的质量分数比$FeO_{x}$的大,D正确。
12. (2025·德阳月考)某技术人员对甲醛(HCHO)、醋酸$(CH_3COOH)、$乳酸$(C_3H_6O_3)$的混合水溶液进行测定,发现其中氧元素的质量分数为 32%,则该溶液中碳元素的质量分数为(
A.30%
B.48%
C.64%
D.68%
C
)A.30%
B.48%
C.64%
D.68%
答案:
C 解析:根据甲醛、醋酸、乳酸的化学式可知每个分子中氢、氧原子个数之比均为2:1,与水分子($H_{2}O$)中氢、氧原子个数比相同,因此混合水溶液中氢、氧元素质量之比为2:16 = 1:8,其中氧元素的质量分数为32%,则氢元素的质量分数为4%,因此混合水溶液中碳元素的质量分数为1 - 32% - 4% = 64%。
13. (10 分)(2025·咸阳期中)我国古代制黄铜的原理如下图所示,请用化学用语回答:

(1)两个锌离子
$(2)Cu_2O $中铜元素的化合价为
(3)“C”表示的宏观意义是
$(4)CO_2$中数字“2”的含义是

(1)两个锌离子
2Zn^{2+}
。$(2)Cu_2O $中铜元素的化合价为
+1
。(3)“C”表示的宏观意义是
木炭这种物质(或碳元素)
。$(4)CO_2$中数字“2”的含义是
一个二氧化碳分子中含有两个氧原子
。
答案:
(1)$2Zn^{2+}$
(2)+1
(3)木炭这种物质(或碳元素)
(4)一个二氧化碳分子中含有两个氧原子
(1)$2Zn^{2+}$
(2)+1
(3)木炭这种物质(或碳元素)
(4)一个二氧化碳分子中含有两个氧原子
14. (10 分)(2025·重庆期中)高锰酸钾是一种重要的化工产品。有关锰元素的“化合价与物质类别”对应关系和制取高锰酸钾的工艺流程如图所示。
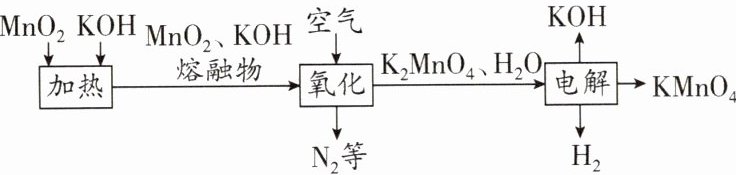
(1)a 点对应的物质类别为
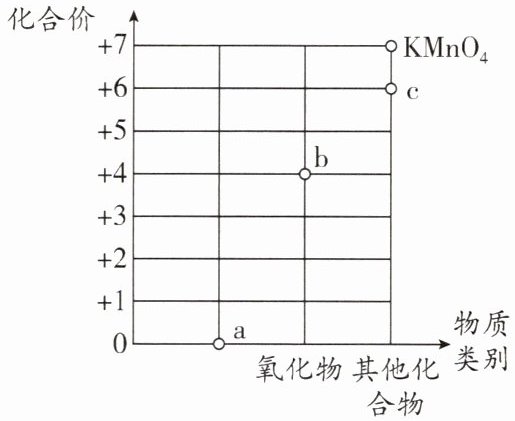
(2)b 点对应物质的化学式为
(3)“电解”步骤中,化合价发生变化的是
(4)流程中可循环利用的物质是

(1)a 点对应的物质类别为
单质
。
(2)b 点对应物质的化学式为
MnO₂
。(3)“电解”步骤中,化合价发生变化的是
Mn、H
(填元素符号)。(4)流程中可循环利用的物质是
KOH
。
答案:
(1)单质
(2)$MnO_{2}$
(3)Mn、H
(4)KOH
解析:
(1)单质中元素的化合价为0,则a点对应的物质类别为单质。
(2)b点表示氧化物,其中锰元素的化合价为+4,氧元素显 - 2价,根据化合物中正、负化合价的代数和为0,b点对应物质的化学式为$MnO_{2}$。
(3)钾元素显+1价,氧元素显 - 2价,根据在化合物中正、负化合价代数和为0,则$K_{2}MnO_{4}$中锰元素的化合价为+6,$KMnO_{4}$中锰元素的化合价为+7,锰元素的化合价发生了改变;$H_{2}O$中氢元素的化合价为+1,$H_{2}$中氢元素的化合价为0,氢元素的化合价发生了改变。
(4)由流程图可知,该流程中氢氧化钾既是反应物,又是生成物,则该流程中可循环利用的物质是氢氧化钾。
(1)单质
(2)$MnO_{2}$
(3)Mn、H
(4)KOH
解析:
(1)单质中元素的化合价为0,则a点对应的物质类别为单质。
(2)b点表示氧化物,其中锰元素的化合价为+4,氧元素显 - 2价,根据化合物中正、负化合价的代数和为0,b点对应物质的化学式为$MnO_{2}$。
(3)钾元素显+1价,氧元素显 - 2价,根据在化合物中正、负化合价代数和为0,则$K_{2}MnO_{4}$中锰元素的化合价为+6,$KMnO_{4}$中锰元素的化合价为+7,锰元素的化合价发生了改变;$H_{2}O$中氢元素的化合价为+1,$H_{2}$中氢元素的化合价为0,氢元素的化合价发生了改变。
(4)由流程图可知,该流程中氢氧化钾既是反应物,又是生成物,则该流程中可循环利用的物质是氢氧化钾。
15. (10 分)如图是自来水厂净水过程示意图:
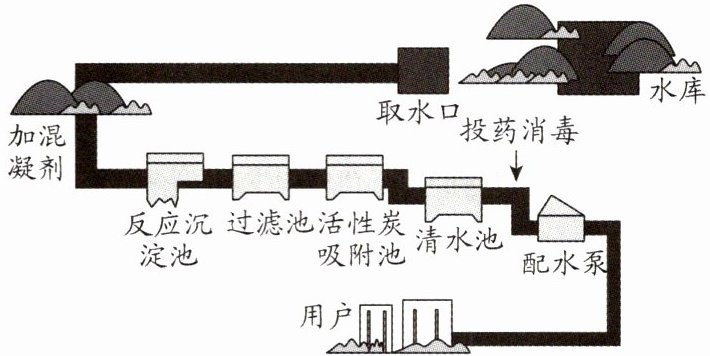
(1)自来水厂输送到用户的自来水
(2)自来水厂取水后可加入明矾作混凝剂。明矾$[KAl(SO_4)_2·12H_2O]$可用于净水,是因为明矾溶于水生成的胶状物可以
(3)生产自来水时,“投药消毒”过程中发生了
(4)水是一切生命体生存所必需的物质,每一位公民都要爱惜水资源、保护水环境、防治水污染。目前我国普遍实行了河长制,责任是督促公民一方面要节约用水,另一方面要防治水体污染。假如你是河长,你与公民分享的节水窍门有:

(1)自来水厂输送到用户的自来水
不是
(填“是”或“不是”)纯水。(2)自来水厂取水后可加入明矾作混凝剂。明矾$[KAl(SO_4)_2·12H_2O]$可用于净水,是因为明矾溶于水生成的胶状物可以
吸附
悬浮于水中的杂质,使之从水中沉降出来。(3)生产自来水时,“投药消毒”过程中发生了
化学
(填“物理”或“化学”)变化。(4)水是一切生命体生存所必需的物质,每一位公民都要爱惜水资源、保护水环境、防治水污染。目前我国普遍实行了河长制,责任是督促公民一方面要节约用水,另一方面要防治水体污染。假如你是河长,你与公民分享的节水窍门有:
用洗菜水浇花(合理即可)
等。
答案:
(1)不是
(2)吸附
(3)化学
(4)用洗菜水浇花(合理即可)
(1)不是
(2)吸附
(3)化学
(4)用洗菜水浇花(合理即可)
16. 水是地球上最普通、最常见的物质之一,不仅江河湖海中含有水,各种生物体也都含有水。下面是关于水的几个小实验。
(1)同学们从一水沟中取出了一些浊水,请你参与他们的实验,并完成有关问题。

①甲图中的装置是实验室中过滤水常用的装置,写出下列仪器的名称。
A
②通过甲操作后,得到的滤液一定是
a. 无色
b. 无味
c. 澄清透明
d. 纯净物
(2)如图乙所示是同学们制作的简易净水器。小卵石、石英砂和蓬松棉的作用是
(3)【提出问题】水的化学式是$ H_2O,$它能不能是 HO、$HO_2$或其他呢?
【探究课题】水的化学式的推导过程。我的假设:水的化学式是$ H_2O、$HO 或$ HO_2。$
【探究准备】精密电解水设备(图丙)。
【探究过程】①用精密的电解水设备电解水,同时测定两试管中逸出气体的体积,记录在下表中:
|时间/min|1|2|3|4|5|6|7|8|
|连电源负极的管(X)中气体/mL|6|12|20|29|39|49|59|69|
|连电源正极的管(Y)中气体/mL|2|4|7|11|16|21|26|31|
②分析上表中数据可知:电解水时,与电源负极相连的试管中收集到的氢气的体积较多,与电源正极相连的试管中收集到的氧气的体积较少,从第 4 min 开始生成的氢气和氧气的体积比约为
③查阅资料可知:在标准状况下,氢气的密度是 0.089 g/L,氧气的密度是 1.429 g/L。由此可计算出生成的氢气和氧气的质量比约为
④利用化合物各元素质量比的算法,设水的化学式为 HₓOᵧ,根据各元素的质量比= 各元素相对原子质量与相应原子个数乘积之比,得出水中氢、氧元素的质量比为
【探究结论】水的化学式是
(1)同学们从一水沟中取出了一些浊水,请你参与他们的实验,并完成有关问题。

①甲图中的装置是实验室中过滤水常用的装置,写出下列仪器的名称。
A
玻璃棒
;B铁架台
;C漏斗
。②通过甲操作后,得到的滤液一定是
c
(填字母)。a. 无色
b. 无味
c. 澄清透明
d. 纯净物
(2)如图乙所示是同学们制作的简易净水器。小卵石、石英砂和蓬松棉的作用是
过滤
。(3)【提出问题】水的化学式是$ H_2O,$它能不能是 HO、$HO_2$或其他呢?
【探究课题】水的化学式的推导过程。我的假设:水的化学式是$ H_2O、$HO 或$ HO_2。$
【探究准备】精密电解水设备(图丙)。
【探究过程】①用精密的电解水设备电解水,同时测定两试管中逸出气体的体积,记录在下表中:
|时间/min|1|2|3|4|5|6|7|8|
|连电源负极的管(X)中气体/mL|6|12|20|29|39|49|59|69|
|连电源正极的管(Y)中气体/mL|2|4|7|11|16|21|26|31|
②分析上表中数据可知:电解水时,与电源负极相连的试管中收集到的氢气的体积较多,与电源正极相连的试管中收集到的氧气的体积较少,从第 4 min 开始生成的氢气和氧气的体积比约为
2:1
。③查阅资料可知:在标准状况下,氢气的密度是 0.089 g/L,氧气的密度是 1.429 g/L。由此可计算出生成的氢气和氧气的质量比约为
1:8
。④利用化合物各元素质量比的算法,设水的化学式为 HₓOᵧ,根据各元素的质量比= 各元素相对原子质量与相应原子个数乘积之比,得出水中氢、氧元素的质量比为
x:16y
,所以有x:16y = 1:8
,解得 x:y=2:1
。【探究结论】水的化学式是
$H_{2}O$
。
答案:
(1)①玻璃棒 铁架台 漏斗 ②c
(2)过滤
(3)②2:1 ③1:8 ④x:16y x:16y = 1:8 2:1 【探究结论】$H_{2}O$
解析:
(1)①由图示可知,仪器A是玻璃棒,B是铁架台,C是漏斗。 ②过滤操作只能除去水中的难溶性杂质,不能除去异味、色素,水中的可溶性物质也不能除去,故得到的滤液不是纯净物。
(2)小卵石、石英砂和蓬松棉能除去水中不溶性的杂质,作用是过滤。
(3)②由表中数据可计算出从第4min开始,相同时间内收集到的氢气和氧气的体积比约为2:1。 ③电解水时生成的氢气和氧气的质量比约为$(2×0.089)g:(1×1.429)g≈1:8$。 ④根据题中信息,由水的化学式$H_{x}O_{y}$可得水中氢、氧两元素的质量比为x:16y,因此x:16y = 1:8,得x:y = 2:1。 【探究结论】水的化学式为$H_{2}O$。
(1)①玻璃棒 铁架台 漏斗 ②c
(2)过滤
(3)②2:1 ③1:8 ④x:16y x:16y = 1:8 2:1 【探究结论】$H_{2}O$
解析:
(1)①由图示可知,仪器A是玻璃棒,B是铁架台,C是漏斗。 ②过滤操作只能除去水中的难溶性杂质,不能除去异味、色素,水中的可溶性物质也不能除去,故得到的滤液不是纯净物。
(2)小卵石、石英砂和蓬松棉能除去水中不溶性的杂质,作用是过滤。
(3)②由表中数据可计算出从第4min开始,相同时间内收集到的氢气和氧气的体积比约为2:1。 ③电解水时生成的氢气和氧气的质量比约为$(2×0.089)g:(1×1.429)g≈1:8$。 ④根据题中信息,由水的化学式$H_{x}O_{y}$可得水中氢、氧两元素的质量比为x:16y,因此x:16y = 1:8,得x:y = 2:1。 【探究结论】水的化学式为$H_{2}O$。
查看更多完整答案,请扫码查看


