第87页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
13. 新考法 (2023·南通中考)化学储氢材料研发是当下科技研究的热点之一。
(1)下列化学储氢材料中含氢量最高的是
A. ${NH_{3}}$
B. ${N_{2}H_{4}}$
C. ${CH_{4}}$
(2)我国科学家发明了一种将甲烷中的氢转化为氢气的工艺(原理如图所示)。

总反应的化学方程式为${CH_{4} + H_{2}O\xlongequal{}CO + 3H_{2}}$。
①反应器Ⅰ中的化学反应方程式为
②当甲烷的转化率($\frac{参加反应的甲烷质量}{反应前甲烷的质量}×100\%$)为80%时,理论上1.0 t甲烷与足量水蒸气反应生成氢气的总质量是
(1)下列化学储氢材料中含氢量最高的是
C
(填字母)。A. ${NH_{3}}$
B. ${N_{2}H_{4}}$
C. ${CH_{4}}$
(2)我国科学家发明了一种将甲烷中的氢转化为氢气的工艺(原理如图所示)。

总反应的化学方程式为${CH_{4} + H_{2}O\xlongequal{}CO + 3H_{2}}$。
①反应器Ⅰ中的化学反应方程式为
$H_{2}O + Ce_{2}O_{3}\overset{400^{\circ}C}{=}2CeO_{2} + H_{2}$
。②当甲烷的转化率($\frac{参加反应的甲烷质量}{反应前甲烷的质量}×100\%$)为80%时,理论上1.0 t甲烷与足量水蒸气反应生成氢气的总质量是
0.3
t。(写出计算过程)
答案:
(1) C
(2) ① $H_{2}O + Ce_{2}O_{3}\overset{400^{\circ}C}{=}2CeO_{2} + H_{2}$ ② 0.3
解:设理论上 1.0 t 甲烷和足量水蒸气反应生成氢气的质量为 x。
$CH_{4} + H_{2}O = CO + 3H_{2}$
16 6
$1.0t×80\%$ x
$\frac{16}{6} = \frac{1.0t×80\%}{x}$
$x = 0.3t$
答:理论上 1.0 t 甲烷和足量水蒸气反应生成氢气的质量为 0.3 t。
解析:
(1) $NH_{3}$ 中氮元素和氢元素的质量比是 $14:3 = 56:12$; $N_{2}H_{4}$ 中氮元素和氢元素的质量比是 $(14×2):(1×4) = 28:4 = 84:12$; $CH_{4}$ 中碳元素和氢元素的质量比是 $12:4 = 36:12$,故甲烷中氢元素的质量分数最大。
(2)①根据题意,该反应是 $H_{2}O$ 和 $Ce_{2}O_{3}$ 在 400℃时反应生成 $CeO_{2}$ 和 $H_{2}$,化学方程式为 $H_{2}O + Ce_{2}O_{3}\overset{400^{\circ}C}{=}2CeO_{2} + H_{2}$。
(1) C
(2) ① $H_{2}O + Ce_{2}O_{3}\overset{400^{\circ}C}{=}2CeO_{2} + H_{2}$ ② 0.3
解:设理论上 1.0 t 甲烷和足量水蒸气反应生成氢气的质量为 x。
$CH_{4} + H_{2}O = CO + 3H_{2}$
16 6
$1.0t×80\%$ x
$\frac{16}{6} = \frac{1.0t×80\%}{x}$
$x = 0.3t$
答:理论上 1.0 t 甲烷和足量水蒸气反应生成氢气的质量为 0.3 t。
解析:
(1) $NH_{3}$ 中氮元素和氢元素的质量比是 $14:3 = 56:12$; $N_{2}H_{4}$ 中氮元素和氢元素的质量比是 $(14×2):(1×4) = 28:4 = 84:12$; $CH_{4}$ 中碳元素和氢元素的质量比是 $12:4 = 36:12$,故甲烷中氢元素的质量分数最大。
(2)①根据题意,该反应是 $H_{2}O$ 和 $Ce_{2}O_{3}$ 在 400℃时反应生成 $CeO_{2}$ 和 $H_{2}$,化学方程式为 $H_{2}O + Ce_{2}O_{3}\overset{400^{\circ}C}{=}2CeO_{2} + H_{2}$。
14. 一黑紫色的固体为${KMnO_{4}}和{MnO_{2}}$的混合物,为测定混合物中${KMnO_{4}}$的质量分数,某同学取样20.0 g,对固体充分加热,测得固体质量随反应时间变化的曲线如图。
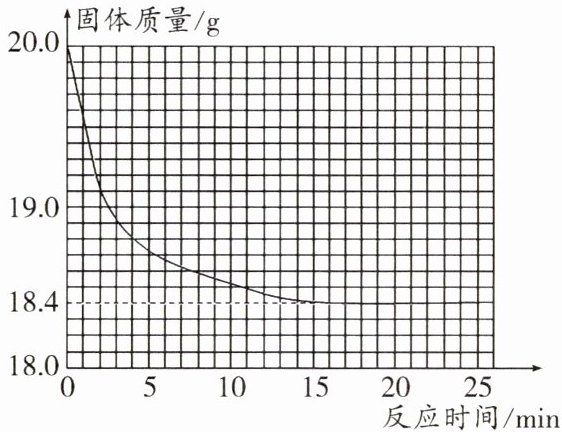
(1)生成氧气的总质量为______g(精确到小数点后一位)。
(2)求样品中${KMnO_{4}}$的质量分数(写出计算过程)。
(3)请画出在实验过程中${MnO_{2}}$的质量随时间变化的坐标图。

(1)生成氧气的总质量为______g(精确到小数点后一位)。
(2)求样品中${KMnO_{4}}$的质量分数(写出计算过程)。
(3)请画出在实验过程中${MnO_{2}}$的质量随时间变化的坐标图。
答案:
(1) 1.6
(2) 79%(过程见解析)
(3) 如图所示

解析:
(1)根据质量守恒定律,生成氧气的质量为 $20.0g - 18.4g = 1.6g$。
(2)设样品中高锰酸钾的质量为 x,生成 $MnO_{2}$ 的质量为 y。
$2KMnO_{4}\overset{\triangle}{=}K_{2}MnO_{4} + MnO_{2} + O_{2}\uparrow$
316 87 32
x y 1.6 g
$\frac{316}{32} = \frac{x}{1.6g}$,解得:$x = 15.8g$
$\frac{87}{32} = \frac{y}{1.6g}$,解得:$y = 4.35g$
样品中高锰酸钾的质量分数是 $\frac{15.8g}{20.0g}×100\% = 79\%$。
(3)原混合物中二氧化锰的质量为 $20.0g - 15.8g = 4.2g$;二氧化锰的质量从 4.2 g 开始会慢慢增多,直到质量增加到 $4.2g + 4.35g = 8.55g$。
(1) 1.6
(2) 79%(过程见解析)
(3) 如图所示

解析:
(1)根据质量守恒定律,生成氧气的质量为 $20.0g - 18.4g = 1.6g$。
(2)设样品中高锰酸钾的质量为 x,生成 $MnO_{2}$ 的质量为 y。
$2KMnO_{4}\overset{\triangle}{=}K_{2}MnO_{4} + MnO_{2} + O_{2}\uparrow$
316 87 32
x y 1.6 g
$\frac{316}{32} = \frac{x}{1.6g}$,解得:$x = 15.8g$
$\frac{87}{32} = \frac{y}{1.6g}$,解得:$y = 4.35g$
样品中高锰酸钾的质量分数是 $\frac{15.8g}{20.0g}×100\% = 79\%$。
(3)原混合物中二氧化锰的质量为 $20.0g - 15.8g = 4.2g$;二氧化锰的质量从 4.2 g 开始会慢慢增多,直到质量增加到 $4.2g + 4.35g = 8.55g$。
查看更多完整答案,请扫码查看


