第34页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
7. 一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中不正确的是 ( )
|物质|甲|乙|丙|丁|
|反应前的质量/g|50|0.5|0|0|
|反应后的质量/g|23|x|24|3|
A.$ x $ 的值等于 $ 0.5 $
B.甲一定是化合物
C.丙和丁的质量变化比为 $ 8:1 $
D.该反应是化合反应
|物质|甲|乙|丙|丁|
|反应前的质量/g|50|0.5|0|0|
|反应后的质量/g|23|x|24|3|
A.$ x $ 的值等于 $ 0.5 $
B.甲一定是化合物
C.丙和丁的质量变化比为 $ 8:1 $
D.该反应是化合反应
答案:
D
二、判一判
8. 质量守恒定律揭示了化学变化中宏观物质之间的质量关系,与微观过程无关。 ( )
9. 通过化学变化,只能改变世界上物质的种类,不能改变物质的总质量。 ( )
10. 质量守恒定律为定量揭示化学变化的规律提供了理论依据。 ( )
11. 质量守恒定律适用于化学变化和物理变化。 ( )
8. 质量守恒定律揭示了化学变化中宏观物质之间的质量关系,与微观过程无关。 ( )
9. 通过化学变化,只能改变世界上物质的种类,不能改变物质的总质量。 ( )
10. 质量守恒定律为定量揭示化学变化的规律提供了理论依据。 ( )
11. 质量守恒定律适用于化学变化和物理变化。 ( )
答案:
8. × 9. √ 10. √ 11. ×
12. 随着科学的发展,新能源的开发不断取得突破。清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如图(图中的微粒恰好完全反应)所示。请根据微观示意图回答以下问题。
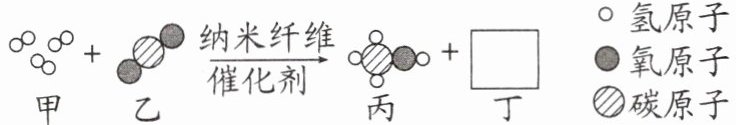
(1) 丁的化学式为____,该反应的化学方程式为____。
(2) 下列说法正确的是____(填写字母)。
A. 反应前后原子数目发生改变
B. 该反应属于复分解反应
C. 甲是单质,乙、丙、丁均为化合物
D. 该反应体现了无机物在一定条件下可以转化为有机物

(1) 丁的化学式为____,该反应的化学方程式为____。
(2) 下列说法正确的是____(填写字母)。
A. 反应前后原子数目发生改变
B. 该反应属于复分解反应
C. 甲是单质,乙、丙、丁均为化合物
D. 该反应体现了无机物在一定条件下可以转化为有机物
答案:
(1) $ H_2O $ $ 3H_2 + CO_2 \xlongequal[\text{催化剂}]{\text{纳米纤维}} CH_3OH + H_2O $
(2) CD
(1) $ H_2O $ $ 3H_2 + CO_2 \xlongequal[\text{催化剂}]{\text{纳米纤维}} CH_3OH + H_2O $
(2) CD
13. 以下是俄国化学家罗蒙诺索夫曾开展的实验:
①先用天平称取质量为 $ m_1 $ 的金属锡粉。
②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质。称量容器的总质量为 $ m_2 $。
③打开容器,听到了空气进入容器发出的“嘶嘶”的声响,称量所得白色物质的质量为 $ m_3 $。
④把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为 $ m_4 $。
(1) 根据所学知识判断:锡的燃烧是____变化。
(2) 罗蒙诺索夫分析数据后发现,生成白色物质的质量 $ m_3 = $____,于是提出了“参加反应的物质的总质量等于反应后产物的总质量”的观点。
(3) 后经多位科学家的共同努力,最终确立了质量守恒定律。请从微观角度解释该定律____。
①先用天平称取质量为 $ m_1 $ 的金属锡粉。
②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质。称量容器的总质量为 $ m_2 $。
③打开容器,听到了空气进入容器发出的“嘶嘶”的声响,称量所得白色物质的质量为 $ m_3 $。
④把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为 $ m_4 $。
(1) 根据所学知识判断:锡的燃烧是____变化。
(2) 罗蒙诺索夫分析数据后发现,生成白色物质的质量 $ m_3 = $____,于是提出了“参加反应的物质的总质量等于反应后产物的总质量”的观点。
(3) 后经多位科学家的共同努力,最终确立了质量守恒定律。请从微观角度解释该定律____。
答案:
(1) 化学
(2) $ m_4 - m_2 + m_1 $
(3) 因为化学反应的过程是原子的重新组合过程,反应前后原子的种类和数目不变,所以化学反应前后物质的总质量相等
(1) 化学
(2) $ m_4 - m_2 + m_1 $
(3) 因为化学反应的过程是原子的重新组合过程,反应前后原子的种类和数目不变,所以化学反应前后物质的总质量相等
14. 某补钙剂的主要成分为碳酸钙(其他成分不溶于水,也不与酸反应)。为了测定该补钙剂中碳酸钙的质量分数,小明同学称取 $ 20 $ 克补钙剂放入烧杯中,再将 $ 80 $ 克稀盐酸分四次加入,充分反应后,测得的实验数据如表所示:(已知: $ CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow $)
| |第 1 次|第 2 次|第 3 次|第 4 次|
|加入稀盐酸的质量(g)|20|20|20|20|
|烧杯中剩余物质的质量(g)|38.2|56.4|75.6|95.6|
(1) 第 3 次实验完成后,烧杯中的溶质为____。
(2) 该补钙剂中碳酸钙的质量分数是多少?(写出计算过程)
| |第 1 次|第 2 次|第 3 次|第 4 次|
|加入稀盐酸的质量(g)|20|20|20|20|
|烧杯中剩余物质的质量(g)|38.2|56.4|75.6|95.6|
(1) 第 3 次实验完成后,烧杯中的溶质为____。
(2) 该补钙剂中碳酸钙的质量分数是多少?(写出计算过程)
答案:
(1) 氯化钙、氯化氢(或 $ CaCl_2 $、HCl)
(2) 解:由质量守恒定律,产生二氧化碳气体的质量为 $ 20g + 80g - 95.6g = 4.4g $。
设该补钙剂中碳酸钙的质量为 $ x $。
$ CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow $
100 44
$ x $ 4.4g
$ \frac{100}{44} = \frac{x}{4.4g} $
$ x = 10g $
该补钙剂中碳酸钙的质量分数 $ = \frac{10g}{20g} × 100\% = 50\% $。
答:该补钙剂中碳酸钙的质量分数为 50%。
(1) 氯化钙、氯化氢(或 $ CaCl_2 $、HCl)
(2) 解:由质量守恒定律,产生二氧化碳气体的质量为 $ 20g + 80g - 95.6g = 4.4g $。
设该补钙剂中碳酸钙的质量为 $ x $。
$ CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow $
100 44
$ x $ 4.4g
$ \frac{100}{44} = \frac{x}{4.4g} $
$ x = 10g $
该补钙剂中碳酸钙的质量分数 $ = \frac{10g}{20g} × 100\% = 50\% $。
答:该补钙剂中碳酸钙的质量分数为 50%。
查看更多完整答案,请扫码查看


