第67页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
17. [答案含评分细则] 跨学科实践活动(2023 山东青岛中考改编)(10 分)科学种田能有效提高作物产量,助力乡村振兴。草莓适宜生长在弱酸性的土壤中,某地区为种植草莓,对土壤进行检测,“圆梦”活动小组积极参与。请回答下列问题。
取少量土壤样品,加入足量水,搅拌、过滤,测得滤液 pH = 8.2,说明土壤呈碱性,由此判断该土壤不适合种植草莓。
【探究一】
土壤中的碱性物质是什么?
结合已有知识,小组同学猜测碱性物质可能是碳酸钠或氢氧化钠中的一种或两种。
【实验探究】
|操作|现象|结论|
|----|----|----|
|取土壤浸出液少许于试管中,向其中加入______|产生白色沉淀|土壤中的碱性物质只有碳酸钠|
|过滤,向滤液中滴加无色酚酞试液|______|
【探究二】
如何改变土壤的碱性?
查阅资料:向土壤中施加硫粉,硫粉在微生物和水的共同作用下最终生成硫酸。
活动小组按照用量要求向试验田中加入硫粉,3 个月后,再次测得土壤 pH = 6.3,确认可以种植草莓。土壤碱性改变的原因是______(用化学方程式表示)。
【交流反思】
针对该地区土壤,除改变其碱性外,还可以选种适合生长的作物。以下作物中,适合在该地区种植的是______。
|作物|小麦|大豆|海水稻|
|----|----|----|
|适宜生长的 pH 范围|6.0~7.0|6.5~7.5|8.0~9.2|
生长过程中为增加作物产量,还要合理施肥。小组同学认为原碱性土壤中不适合施用铵态氮肥(含铵根离子的盐),从微观角度说明原因:_________________。
取少量土壤样品,加入足量水,搅拌、过滤,测得滤液 pH = 8.2,说明土壤呈碱性,由此判断该土壤不适合种植草莓。
【探究一】
土壤中的碱性物质是什么?
结合已有知识,小组同学猜测碱性物质可能是碳酸钠或氢氧化钠中的一种或两种。
【实验探究】
|操作|现象|结论|
|----|----|----|
|取土壤浸出液少许于试管中,向其中加入______|产生白色沉淀|土壤中的碱性物质只有碳酸钠|
|过滤,向滤液中滴加无色酚酞试液|______|
【探究二】
如何改变土壤的碱性?
查阅资料:向土壤中施加硫粉,硫粉在微生物和水的共同作用下最终生成硫酸。
活动小组按照用量要求向试验田中加入硫粉,3 个月后,再次测得土壤 pH = 6.3,确认可以种植草莓。土壤碱性改变的原因是______(用化学方程式表示)。
【交流反思】
针对该地区土壤,除改变其碱性外,还可以选种适合生长的作物。以下作物中,适合在该地区种植的是______。
|作物|小麦|大豆|海水稻|
|----|----|----|
|适宜生长的 pH 范围|6.0~7.0|6.5~7.5|8.0~9.2|
生长过程中为增加作物产量,还要合理施肥。小组同学认为原碱性土壤中不适合施用铵态氮肥(含铵根离子的盐),从微观角度说明原因:_________________。
答案:
过量的氯化钙(或氯化钡)溶液@@无明显现象@@H₂SO₄ + Na₂CO₃ = Na₂SO₄ + H₂O + CO₂↑@@海水稻 NH₄⁺与 OH⁻反应生成 NH₃和 H₂O(或铵根离子与氢氧根离子反应生成氨分子和水分子)
四、计算题(共 7 分)
答案:
18. [答案含评分细则](2024 山东滨州中考)(7 分)黄铜(铜和锌的合金)是一种重要的金属材料,常用于制造轴承、齿轮等机器零件。为回收黄铜中的铜,某化学兴趣小组的同学取黄铜样品粉末 32.5 g,放入烧杯中,然后逐渐加入稀硫酸至过量。所加稀硫酸的质量与剩余固体的质量关系如图所示。
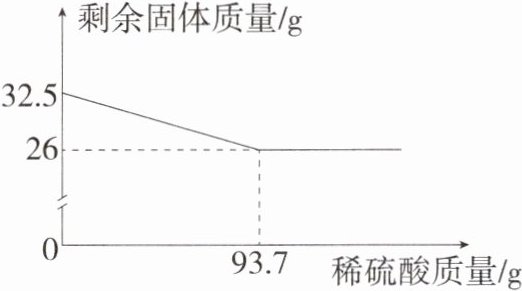
试计算:
(1)黄铜样品中铜的质量为______g。
(2)恰好完全反应时,所得溶液的溶质质量分数是多少?

试计算:
(1)黄铜样品中铜的质量为______g。
(2)恰好完全反应时,所得溶液的溶质质量分数是多少?
答案:
(1)26(1 分)
(2)解:设反应生成硫酸锌的质量是 x,反应生成氢气的质量是 y。
锌的质量是 32.5 g - 26 g = 6.5 g (1 分)
Zn + H₂SO₄ = ZnSO₄ + H₂↑ (1 分)
65 161 2
6.5 g x y
$\frac{65}{161}=\frac{6.5 g}{x}$ x = 16.1 g (1 分)
$\frac{65}{2}=\frac{6.5 g}{y}$ y = 0.2 g (1 分)
恰好完全反应时,所得溶液的溶质质量分数是 $\frac{16.1 g}{6.5 g + 93.7 g - 0.2 g}$×100% = 16.1% (1 分)
答:恰好完全反应时,所得溶液中的溶质质量分数是 16.1%。
(2)解:设反应生成硫酸锌的质量是 x,反应生成氢气的质量是 y。
锌的质量是 32.5 g - 26 g = 6.5 g (1 分)
Zn + H₂SO₄ = ZnSO₄ + H₂↑ (1 分)
65 161 2
6.5 g x y
$\frac{65}{161}=\frac{6.5 g}{x}$ x = 16.1 g (1 分)
$\frac{65}{2}=\frac{6.5 g}{y}$ y = 0.2 g (1 分)
恰好完全反应时,所得溶液的溶质质量分数是 $\frac{16.1 g}{6.5 g + 93.7 g - 0.2 g}$×100% = 16.1% (1 分)
答:恰好完全反应时,所得溶液中的溶质质量分数是 16.1%。
查看更多完整答案,请扫码查看


