第27页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
7. 已知X物质与Y物质的溶解度都随温度的升高而增大,20 ℃时,10 g水中最多溶解4 g X物质,30 ℃时,20 g水中最多溶解8 g Y物质,则20 ℃时X物质与Y物质的溶解度相比是 ( )
A. X = Y
B. X < Y
C. X > Y
D. 无法比较
A. X = Y
B. X < Y
C. X > Y
D. 无法比较
答案:
C 20℃时,10 g水中最多溶解4 g X物质,则20℃时,X物质的溶解度为40 g;30℃时,20 g水中最多溶解8 g Y物质,则30℃时,Y物质的溶解度为40 g。X物质与Y物质的溶解度都随温度的升高而增大,则20℃时,Y物质的溶解度一定小于40 g,所以20℃时,X物质的溶解度大于Y物质的溶解度。
8. (2023四川内江中考)甲、乙两种物质的溶解度曲线如图所示。下列有关说法错误的是(C9208003) ( )
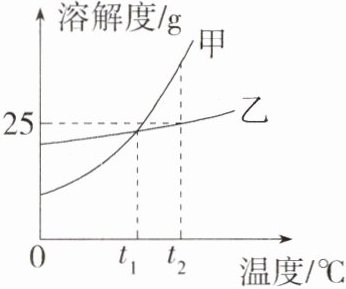
A. 两种物质的溶解度都随温度升高而增大
B. $t_1$℃时,甲、乙两物质的溶液中溶质质量分数一定相等
C. 通常采用蒸发结晶的方法从乙的溶液中获得晶体
D. $t_2$℃时,在100 g水中加入25 g甲,可形成甲的不饱和溶液

A. 两种物质的溶解度都随温度升高而增大
B. $t_1$℃时,甲、乙两物质的溶液中溶质质量分数一定相等
C. 通常采用蒸发结晶的方法从乙的溶液中获得晶体
D. $t_2$℃时,在100 g水中加入25 g甲,可形成甲的不饱和溶液
答案:
B t₁℃时,甲、乙两物质的溶解度相等,则t₁℃时,甲、乙两物质的饱和溶液中溶质质量分数一定相等,故B错误。
9. 如图是甲、乙、丙三种物质的溶解度曲线,请回答下列问题:(C9208003)

(1)$t_1$℃时,丙物质的溶解度是______g。
(2)$t_2$℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是________。
(3)$t_3$℃时,将40 g甲物质加入100 g水中,充分溶解后,所得溶液为________(填“饱和”或“不饱和”)溶液,溶质与溶剂的质量比是________。

(1)$t_1$℃时,丙物质的溶解度是______g。
(2)$t_2$℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是________。
(3)$t_3$℃时,将40 g甲物质加入100 g水中,充分溶解后,所得溶液为________(填“饱和”或“不饱和”)溶液,溶质与溶剂的质量比是________。
答案:
(1)10 (2)甲=乙>丙 (3)饱和 3 : 10
解析 (3)t₃℃时,甲物质的溶解度是30 g,将40 g甲物质加入100 g水中,充分溶解后,只能溶解30 g甲物质,所得溶液为饱和溶液,溶质与溶剂的质量比是30 g : 100 g = 3 : 10。
解析 (3)t₃℃时,甲物质的溶解度是30 g,将40 g甲物质加入100 g水中,充分溶解后,只能溶解30 g甲物质,所得溶液为饱和溶液,溶质与溶剂的质量比是30 g : 100 g = 3 : 10。
10. (2024山东枣庄滕州期末,16,★☆☆)小亮想要测定在一定温度时某固体物质的溶解度,则待测液必须是该温度下该物质的 ( )
A. 浓溶液
B. 稀溶液
C. 不饱和溶液
D. 饱和溶液
A. 浓溶液
B. 稀溶液
C. 不饱和溶液
D. 饱和溶液
答案:
D 固体物质的溶解度是在一定温度下,某固体物质在100 g溶剂里达到饱和状态时所溶解的质量,所以待测液必须是该温度下该固体物质的饱和溶液。
11. (2024四川遂宁中考,6,★☆☆)如图是$KNO_3$和$NaCl$两种固体物质的溶解度曲线(不考虑水分的蒸发,析出的晶体中不含结晶水)。下列说法正确的是 ( )
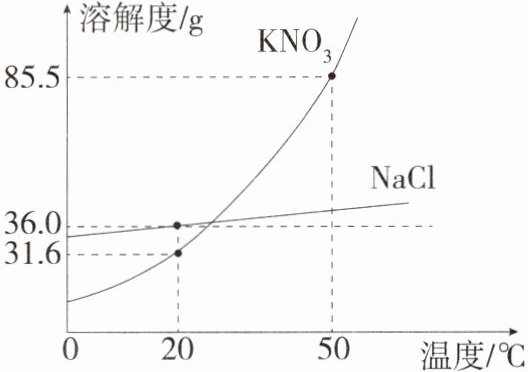
A. 50 ℃时,将185.5 g的$KNO_3$饱和溶液降温到20 ℃,析出晶体的质量为53.9 g
B. $NaCl$的溶解度小于$KNO_3$的溶解度
C. 20 ℃时,$NaCl$饱和溶液的溶质质量分数为36.0%
D. 若$KNO_3$中混有少量的$NaCl$,可用蒸发结晶的方法提纯$KNO_3$

A. 50 ℃时,将185.5 g的$KNO_3$饱和溶液降温到20 ℃,析出晶体的质量为53.9 g
B. $NaCl$的溶解度小于$KNO_3$的溶解度
C. 20 ℃时,$NaCl$饱和溶液的溶质质量分数为36.0%
D. 若$KNO_3$中混有少量的$NaCl$,可用蒸发结晶的方法提纯$KNO_3$
答案:
A
|选项|分析|正误|
| ---- | ---- | ---- |
|A|50℃时KNO₃的溶解度为85.5 g,则50℃时,185.5 g的KNO₃饱和溶液中含有85.5 g KNO₃,含有100 g水,降温到20℃,20℃时KNO₃的溶解度为31.6 g,则析出晶体的质量为85.5 g - 31.6 g = 53.9 g|√|
|B|由于没有指明温度,因此无法比较NaCl与KNO₃的溶解度大小|×|
|C|20℃时,NaCl的溶解度为36.0 g,NaCl饱和溶液的溶质质量分数为$\frac{36.0 g}{36.0 g + 100 g}$×100% < 36.0%|×|
|D|KNO₃的溶解度受温度的影响变化较大,而NaCl的溶解度受温度的影响变化较小,若KNO₃中混有少量的NaCl,可用降温结晶的方法提纯KNO₃|×|
12. (2023山东济宁中考,6,★☆☆)$t_1$℃时,将等质量的硝酸钾和氯化钾分别加入盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。下列说法错误的是 ( )
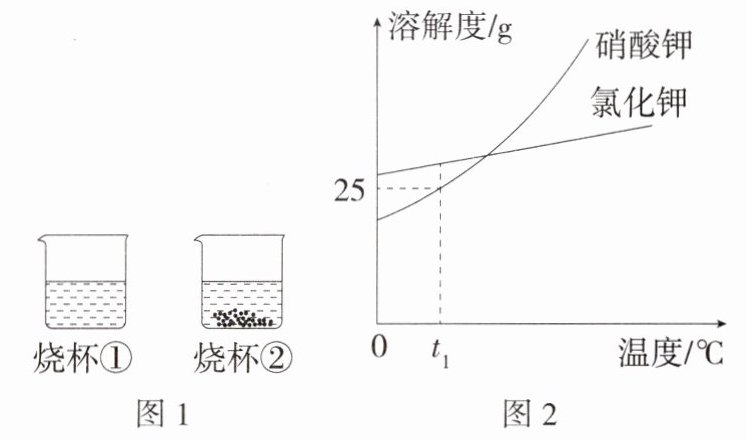
A. 烧杯①中溶解的溶质是氯化钾
B. 烧杯②中的上层清液属于饱和溶液
C. 将$t_1$℃时50 g硝酸钾的饱和溶液稀释成5%的溶液,需加水150 g
D.$t_1$℃时,将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体

A. 烧杯①中溶解的溶质是氯化钾
B. 烧杯②中的上层清液属于饱和溶液
C. 将$t_1$℃时50 g硝酸钾的饱和溶液稀释成5%的溶液,需加水150 g
D.$t_1$℃时,将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
答案:
D t₁℃时,氯化钾的溶解度大于硝酸钾的溶解度,由图1可知,烧杯①中物质全部溶解,烧杯②中物质部分溶解,因此烧杯①中溶解的溶质是氯化钾,烧杯②中溶解的溶质是硝酸钾,故A正确;烧杯②中的物质部分溶解,因此上层清液属于饱和溶液,故B正确;t₁℃时硝酸钾饱和溶液的溶质质量分数为$\frac{25 g}{100 g + 25 g}$×100% = 20%,则将t₁℃时50 g硝酸钾的饱和溶液稀释成5%的溶液,需加水的质量为50 g×20%÷5% - 50 g = 150 g,故C正确;t₁℃时,将两个烧杯中的溶液混合,充分搅拌后,烧杯中的水的质量是原来的2倍,结合图2分析可知,所得溶液为硝酸钾和氯化钾的不饱和溶液,烧杯中一定没有剩余固体,故D错误。
查看更多完整答案,请扫码查看


