第58页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
1. (2024 山东青岛市南一模) 兴趣小组同学利用暖宝宝贴 (主要成分为铁粉、氯化钠、水等) 测定空气中氧气含量。按如图组装装置并检查装置气密性,一段时间后打开止水夹,水倒吸入锥形瓶,测得实验数据如下表所示。下列关于实验的分析不合理的是 ( )
|实验前的体积|实验后的体积|
| ---- | ---- |
|锥形瓶内空气 (含导管内空气)|量筒内水|量筒内水|
|250 mL|100 mL|52 mL|

A. 该实验原理是利用铁锈蚀消耗氧气
B. 暖宝宝贴中的氯化钠可以加快铁粉的锈蚀
C. 计算得出空气中氧气的体积分数为 20.8%
D. 若实验测得空气中氧气含量偏低,可能是因为装置未恢复至室温就打开止水夹
|实验前的体积|实验后的体积|
| ---- | ---- |
|锥形瓶内空气 (含导管内空气)|量筒内水|量筒内水|
|250 mL|100 mL|52 mL|

A. 该实验原理是利用铁锈蚀消耗氧气
B. 暖宝宝贴中的氯化钠可以加快铁粉的锈蚀
C. 计算得出空气中氧气的体积分数为 20.8%
D. 若实验测得空气中氧气含量偏低,可能是因为装置未恢复至室温就打开止水夹
答案:
C@@计算得出空气中氧气的体积分数为$\frac{100\ mL - 52\ mL}{250\ mL}×100\% = 19.2\%$,故C错误。
2. (2024 广东深圳龙岗二模) 铁生锈的原理能用于制作 “暖宝宝”。某 “暖宝宝” 的成分为铁粉、蛭石 (保温作用)、吸水性树脂、食盐和活性炭。探究小组利用如图 1 装置进行探究,实验结果如图 2。下列说法错误的是 ( )
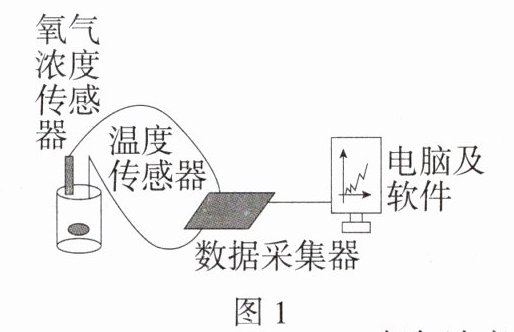

A. “暖宝宝” 发热原理是 Fe 粉与 H₂O、O₂反应
B. 由 O₂浓度变化推测,Fe 粉可用作食品脱氧剂
C. 封装 “暖宝宝” 的外包装袋应选透水、透气的材料
D. “暖宝宝” 能快速放热,铁钉生锈需较长时间,说明反应物表面积是影响反应速率的因素之一


A. “暖宝宝” 发热原理是 Fe 粉与 H₂O、O₂反应
B. 由 O₂浓度变化推测,Fe 粉可用作食品脱氧剂
C. 封装 “暖宝宝” 的外包装袋应选透水、透气的材料
D. “暖宝宝” 能快速放热,铁钉生锈需较长时间,说明反应物表面积是影响反应速率的因素之一
答案:
C@@铁的锈蚀过程中会放出热量,因此“暖宝宝”发热原理是Fe与$H_2O$、$O_2$反应,A正确;由图2可知,装置内的氧气的浓度逐渐降至较低浓度,说明有氧气被消耗,因此Fe粉可用作食品脱氧剂,B正确;封装“暖宝宝”的外包装袋应选不透水、不透气的材料,这样才能保证“暖宝宝”不失效,C错误;“暖宝宝”中的铁粉反应能快速放热,铁钉生锈需较长时间,说明反应物的表面积是影响反应速率的因素之一,D正确。
3. 暖宝宝是常见的局部取暖贴剂,使用后的固体中含 Fe₂O₃、Fe(OH)₃、NaCl、铁粉、炭粉和蛭石。为探究其中各组分的性质和含量,化学项目小组进行如下实验 [已知:蛭石呈黄褐色,不溶于水,不参加反应;Cu + Fe₂(SO₄)₃ = CuSO₄ + 2FeSO₄]。
(1) 取出使用后暖宝宝中的固体,观察到部分呈黑色。呈黑色的物质是 ________。
(2) 称取 15.00 g 样品,加入足量水,充分搅拌,过滤得到 14.00 g 滤渣甲。向滤渣甲中加入过量的硝酸铜溶液,充分反应后过滤,得到 15.20 g 滤渣乙。铁与硝酸铜反应的化学方程式为 ______________。
(3) 向滤渣乙中加入稀硫酸至过量,充分反应后过滤,得到滤液和 10.18 g 滤渣丙,滤渣丙中有紫红色固体。所得滤液中的阳离子是 ____________ (填离子符号)。
(4) 将滤渣丙放入硬质玻璃管中,用如图所示装置继续实验 (装置中试剂均足量)。

加热硬质玻璃管中的固体至恒重,其质量为 11.06 g,装置 D 的质量增加 4.40 g。滤渣丙中铜的质量为 __________。
(1) 取出使用后暖宝宝中的固体,观察到部分呈黑色。呈黑色的物质是 ________。
(2) 称取 15.00 g 样品,加入足量水,充分搅拌,过滤得到 14.00 g 滤渣甲。向滤渣甲中加入过量的硝酸铜溶液,充分反应后过滤,得到 15.20 g 滤渣乙。铁与硝酸铜反应的化学方程式为 ______________。
(3) 向滤渣乙中加入稀硫酸至过量,充分反应后过滤,得到滤液和 10.18 g 滤渣丙,滤渣丙中有紫红色固体。所得滤液中的阳离子是 ____________ (填离子符号)。
(4) 将滤渣丙放入硬质玻璃管中,用如图所示装置继续实验 (装置中试剂均足量)。

加热硬质玻璃管中的固体至恒重,其质量为 11.06 g,装置 D 的质量增加 4.40 g。滤渣丙中铜的质量为 __________。
答案:
(1)铁粉、炭粉(或Fe、C)
(2)$Fe + Cu(NO_3)_2 = Fe(NO_3)_2 + Cu$
(3)$H^+$、$Cu^{2+}$、$Fe^{2+}$
(4)8.32 g
解析 整个实验流程分析如图所示:
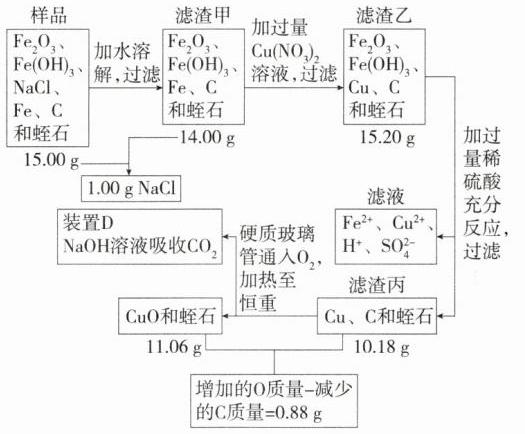
(4)由以上分析可知,滤渣丙中含有铜、炭粉和蛭石,硬质玻璃管中发生反应:$C + O_2\xlongequal{\triangle}CO_2$、$2Cu + O_2\xlongequal{\triangle}2CuO$。装置D的作用是吸收装置C中产生的$CO_2$,装置D的质量增加4.40 g,则装置C中产生二氧化碳的质量为4.40 g。
设滤渣丙中炭粉的质量为x。
$C + O_2\xlongequal{\triangle}CO_2$
12 44
x 4.40 g
$\frac{12}{44}=\frac{x}{4.40\ g}$,$x = 1.20\ g$
与铜反应的氧气的质量即为氧化铜中氧元素的质量,为1.20 g + 0.88 g = 2.08 g。$CuO$中,Cu与O的质量比为64 : 16,设反应生成的$CuO$中铜元素的质量为y,$\frac{64}{16}=\frac{y}{2.08\ g}$,$y = 8.32\ g$。根据质量守恒定律,反应前后元素的质量不变,则滤渣丙中铜的质量为8.32 g。
(1)铁粉、炭粉(或Fe、C)
(2)$Fe + Cu(NO_3)_2 = Fe(NO_3)_2 + Cu$
(3)$H^+$、$Cu^{2+}$、$Fe^{2+}$
(4)8.32 g
解析 整个实验流程分析如图所示:

(4)由以上分析可知,滤渣丙中含有铜、炭粉和蛭石,硬质玻璃管中发生反应:$C + O_2\xlongequal{\triangle}CO_2$、$2Cu + O_2\xlongequal{\triangle}2CuO$。装置D的作用是吸收装置C中产生的$CO_2$,装置D的质量增加4.40 g,则装置C中产生二氧化碳的质量为4.40 g。
设滤渣丙中炭粉的质量为x。
$C + O_2\xlongequal{\triangle}CO_2$
12 44
x 4.40 g
$\frac{12}{44}=\frac{x}{4.40\ g}$,$x = 1.20\ g$
与铜反应的氧气的质量即为氧化铜中氧元素的质量,为1.20 g + 0.88 g = 2.08 g。$CuO$中,Cu与O的质量比为64 : 16,设反应生成的$CuO$中铜元素的质量为y,$\frac{64}{16}=\frac{y}{2.08\ g}$,$y = 8.32\ g$。根据质量守恒定律,反应前后元素的质量不变,则滤渣丙中铜的质量为8.32 g。
查看更多完整答案,请扫码查看


