第28页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
13. (2023山东枣庄中考,19,★☆☆)工业上氢氧化钙制取步骤为:煅烧石灰石得生石灰(主要成分是氧化钙),氧化钙和水反应生成氢氧化钙。氢氧化钙固体的溶解度曲线如图所示。下列叙述正确的是(C9208003) ( )
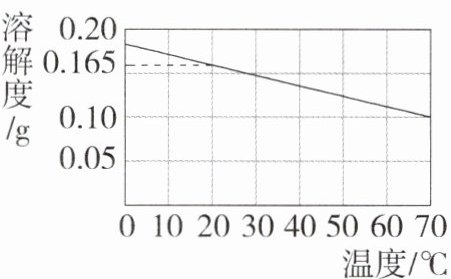
A. 饱和氢氧化钙溶液中加入少量氧化钙,再恢复到原温度,溶液质量不变
B. 10 ℃时饱和氢氧化钙溶液升高温度至40 ℃,溶液变浑浊
C. 20 ℃时饱和氢氧化钙溶液的溶质质量分数计算式可表示为$\frac{0.165 g}{100 g}\times100\%$
D. 50 ℃时饱和氢氧化钙溶液降低温度至20 ℃时,溶质质量分数变小

A. 饱和氢氧化钙溶液中加入少量氧化钙,再恢复到原温度,溶液质量不变
B. 10 ℃时饱和氢氧化钙溶液升高温度至40 ℃,溶液变浑浊
C. 20 ℃时饱和氢氧化钙溶液的溶质质量分数计算式可表示为$\frac{0.165 g}{100 g}\times100\%$
D. 50 ℃时饱和氢氧化钙溶液降低温度至20 ℃时,溶质质量分数变小
答案:
B 向饱和氢氧化钙溶液中加入少量氧化钙,氧化钙和水反应生成氢氧化钙,放热,氢氧化钙溶解度减小,饱和氢氧化钙溶液中有氢氧化钙析出,溶液质量减小,再恢复到原温度,氢氧化钙溶解度增大,部分氢氧化钙溶于水,但因过程中有水消耗,最终溶质、溶剂、溶液质量均减小,故A错误;氢氧化钙的溶解度随着温度的升高而减小,因此将10℃时饱和氢氧化钙溶液升高温度至40℃,溶液变浑浊,故B正确;20℃时氢氧化钙的溶解度是0.165 g,该温度时饱和氢氧化钙溶液的溶质质量分数计算式可表示为$\frac{0.165 g}{100 g + 0.165 g}$×100%,故C错误;将50℃时饱和氢氧化钙溶液降低温度至20℃,饱和溶液变成不饱和溶液,溶液组成不变,溶质质量分数不变,故D错误。
14. (2024山东滨州中考,21,★☆☆)如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。分析图示并回答问题:
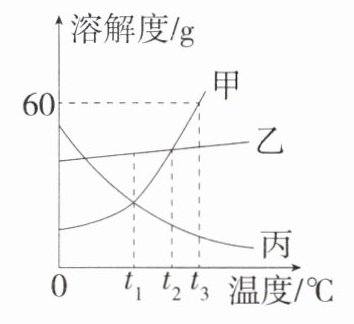
(1) ________℃时,甲、乙两种物质的溶解度相等;
(2) 将$t_3$℃时甲、乙、丙三种物质的饱和溶液分别降温到$t_1$℃,所得溶液的溶质质量分数由大到小的顺序为__________;
(3)$t_3$℃时,欲将30 g甲物质完全溶解配制成该温度下甲的饱和溶液,则需加入水的质量为________g,溶解过程中玻璃棒的作用是________________;
(4) 当乙物质中混有少量甲物质时,可以用__________(填“蒸发结晶”或“降温结晶”)的方法提纯乙。

(1) ________℃时,甲、乙两种物质的溶解度相等;
(2) 将$t_3$℃时甲、乙、丙三种物质的饱和溶液分别降温到$t_1$℃,所得溶液的溶质质量分数由大到小的顺序为__________;
(3)$t_3$℃时,欲将30 g甲物质完全溶解配制成该温度下甲的饱和溶液,则需加入水的质量为________g,溶解过程中玻璃棒的作用是________________;
(4) 当乙物质中混有少量甲物质时,可以用__________(填“蒸发结晶”或“降温结晶”)的方法提纯乙。
答案:
(1)t₂ (2)乙>甲>丙 (3)50 搅拌,加快溶解速率 (4)蒸发结晶
解析 (2)t₃℃时,三种物质的溶解度大小关系是甲>乙>丙,由于甲、乙的溶解度随温度的降低而减小,因此降温至t₁℃时,甲、乙的溶液中都有晶体析出,溶液都是饱和溶液,在t₁℃时三种物质的溶解度大小关系是乙>丙 = 甲,由于丙的溶解度随温度的降低而增大,因此降温至t₁℃时,丙的饱和溶液就会变成不饱和溶液,但溶液的组成未发生改变,溶质的质量分数不变,由题图可知,t₁℃时甲的溶解度大于t₃℃时丙的溶解度,降温后丙的溶液中溶质的质量分数最小,综上,所得溶液中溶质质量分数由大到小的顺序为乙>甲>丙。(3)t₃℃时,甲的溶解度为60 g,欲将30 g甲物质完全溶解配制成t₃℃时的饱和溶液,则需加入水的质量为100 g×$\frac{30 g}{60 g}$ = 50 g;溶解过程中玻璃棒的作用是搅拌,加快溶解速率。(4)乙的溶解度受温度的影响变化较小,甲的溶解度受温度的影响变化较大,当乙物质中混有少量甲物质时,可以用蒸发结晶的方法提纯乙。
解析 (2)t₃℃时,三种物质的溶解度大小关系是甲>乙>丙,由于甲、乙的溶解度随温度的降低而减小,因此降温至t₁℃时,甲、乙的溶液中都有晶体析出,溶液都是饱和溶液,在t₁℃时三种物质的溶解度大小关系是乙>丙 = 甲,由于丙的溶解度随温度的降低而增大,因此降温至t₁℃时,丙的饱和溶液就会变成不饱和溶液,但溶液的组成未发生改变,溶质的质量分数不变,由题图可知,t₁℃时甲的溶解度大于t₃℃时丙的溶解度,降温后丙的溶液中溶质的质量分数最小,综上,所得溶液中溶质质量分数由大到小的顺序为乙>甲>丙。(3)t₃℃时,甲的溶解度为60 g,欲将30 g甲物质完全溶解配制成t₃℃时的饱和溶液,则需加入水的质量为100 g×$\frac{30 g}{60 g}$ = 50 g;溶解过程中玻璃棒的作用是搅拌,加快溶解速率。(4)乙的溶解度受温度的影响变化较小,甲的溶解度受温度的影响变化较大,当乙物质中混有少量甲物质时,可以用蒸发结晶的方法提纯乙。
15. (2024山东济南历城二模节选,17,★☆☆)1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展。该技术以从海水中提取出来的食盐($NaCl$)为主要原料制取纯碱,同时得到可用作氮肥的氯化铵($NH_4Cl$),$NaCl$和$NH_4Cl$的溶解度曲线如图所示。请回答下列问题:

(1)$t_2$℃时,$NH_4Cl$的溶解度是________g。
(2)$t_1$℃时,$NH_4Cl$饱和溶液的溶质质量分数________$NaCl$饱和溶液的溶质质量分数(填“大于”“小于”“等于”或“无法判断”)。
(3)$t_2$℃时,各取$NH_4Cl$和$NaCl$ $a$ g,分别加水至固体刚好完全溶解,配制成饱和溶液,然后降温到$t_1$℃,此时所得$NH_4Cl$饱和溶液的质量________$NaCl$饱和溶液的质量(填“大于”“小于”“等于”或“无法判断”)。

(1)$t_2$℃时,$NH_4Cl$的溶解度是________g。
(2)$t_1$℃时,$NH_4Cl$饱和溶液的溶质质量分数________$NaCl$饱和溶液的溶质质量分数(填“大于”“小于”“等于”或“无法判断”)。
(3)$t_2$℃时,各取$NH_4Cl$和$NaCl$ $a$ g,分别加水至固体刚好完全溶解,配制成饱和溶液,然后降温到$t_1$℃,此时所得$NH_4Cl$饱和溶液的质量________$NaCl$饱和溶液的质量(填“大于”“小于”“等于”或“无法判断”)。
答案:
(1)60 (2)等于 (3)小于
解析 (2)t₁℃时,氯化钠和氯化铵的溶解度相等,所以氯化铵饱和溶液的溶质质量分数等于氯化钠饱和溶液的溶质质量分数;(3)t₂℃时,氯化铵的溶解度大于氯化钠的溶解度,各取NH₄Cl和NaCl a g,分别加水至固体刚好完全溶解,配制成饱和溶液,氯化钠需要的水的质量比氯化铵需要的水的质量多,然后降温到t₁℃,由于氯化铵的溶解度受温度的影响比氯化钠大,且t₁℃时氯化钠和氯化铵的溶解度相等,氯化铵析出晶体质量比氯化钠多,因此此时所得氯化铵饱和溶液的质量小于氯化钠饱和溶液的质量。
查看更多完整答案,请扫码查看


