2025年优化探究同步导学案高中化学必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年优化探究同步导学案高中化学必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第68页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. 铁的氧化物
(1)物理性质及用途

(2)化学性质
①从物质类别的角度分析,$\mathrm{FeO}$、$\mathrm{Fe_2O_3}$都属于
写出下列氧化物与稀盐酸反应的离子方程式:
$\mathrm{FeO}$:
$\mathrm{Fe_2O_3}$:
$\mathrm{Fe_3O_4}$:$\mathrm{Fe_3O_4+8H^+=Fe^{2+}+2Fe^{3+}+4H_2O}$。
②从元素化合价的角度分析,铁的氧化物都具有
a. $\mathrm{FeO}$不稳定,在空气中受热被氧化生成
b. 铁的氧化物与铝粉在高温下可发生反应,$\mathrm{Fe_2O_3}$和$\mathrm{Al}$发生反应的化学方程式:
(1)物理性质及用途

(2)化学性质
①从物质类别的角度分析,$\mathrm{FeO}$、$\mathrm{Fe_2O_3}$都属于
碱性氧化物
。写出下列氧化物与稀盐酸反应的离子方程式:
$\mathrm{FeO}$:
$\mathrm{FeO + 2H^+ = Fe^{2+} + H_2O}$
。$\mathrm{Fe_2O_3}$:
$\mathrm{Fe_2O_3 + 6H^+ = 2Fe^{3+} + 3H_2O}$
。$\mathrm{Fe_3O_4}$:$\mathrm{Fe_3O_4+8H^+=Fe^{2+}+2Fe^{3+}+4H_2O}$。
②从元素化合价的角度分析,铁的氧化物都具有
氧化性
,其中$\mathrm{FeO}$还具有还原性
。a. $\mathrm{FeO}$不稳定,在空气中受热被氧化生成
$\mathrm{Fe_3O_4}$
,$\mathrm{FeO}$在反应中表现还原性
。b. 铁的氧化物与铝粉在高温下可发生反应,$\mathrm{Fe_2O_3}$和$\mathrm{Al}$发生反应的化学方程式:
$\mathrm{Fe_2O_3 + 2Al\xlongequal{高温}2Fe + Al_2O_3}$
,$\mathrm{Fe_2O_3}$在反应中表现氧化性
。该反应放出大量热,常用于焊接钢轨、制备金属纳米复合材料等。
答案:
1.
(1)铁红 磁性氧化铁 +2 +3 +2、+3 黑 红棕 黑
(2)碱性氧化物 FeO + 2H⁺ = Fe²⁺ + H₂O Fe₂O₃ + 6H⁺ = 2Fe³⁺ + 3H₂O 氧化性 还原性 Fe₃O₄ 还原性 Fe₂O₃ + 2Al 高温 2Fe + Al₂O₃ 氧化性
(1)铁红 磁性氧化铁 +2 +3 +2、+3 黑 红棕 黑
(2)碱性氧化物 FeO + 2H⁺ = Fe²⁺ + H₂O Fe₂O₃ + 6H⁺ = 2Fe³⁺ + 3H₂O 氧化性 还原性 Fe₃O₄ 还原性 Fe₂O₃ + 2Al 高温 2Fe + Al₂O₃ 氧化性
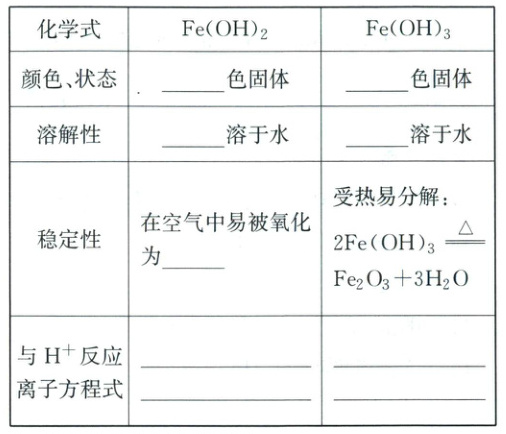
2. 铁的氢氧化物
(1)铁的氢氧化物的性质
(2)铁的氢氧化物的制备
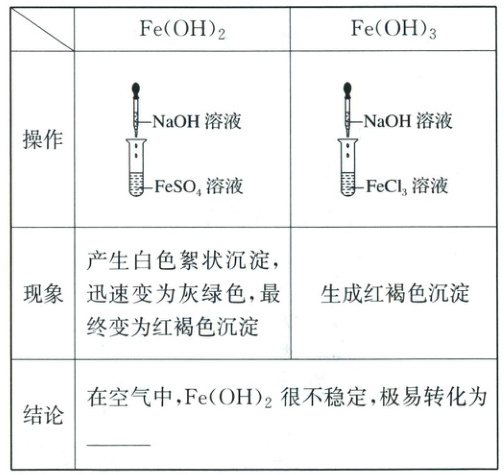
制备$\mathrm{Fe(OH)_2}$的离子方程式是
制备$\mathrm{Fe(OH)_3}$的离子方程式是
$\mathrm{Fe(OH)_2}$转化为$\mathrm{Fe(OH)_3}$的化学方程式是
(1)铁的氢氧化物的性质

(2)铁的氢氧化物的制备

制备$\mathrm{Fe(OH)_2}$的离子方程式是
$\mathrm{Fe^{2+} + 2OH^- = Fe(OH)_2\downarrow}$
;制备$\mathrm{Fe(OH)_3}$的离子方程式是
$\mathrm{Fe^{3+} + 3OH^- = Fe(OH)_3\downarrow}$
。$\mathrm{Fe(OH)_2}$转化为$\mathrm{Fe(OH)_3}$的化学方程式是
$\mathrm{4Fe(OH)_2 + O_2 + 2H_2O = 4Fe(OH)_3}$
。
答案:
2.
(1)白 红褐 难 难 Fe(OH)₃ Fe(OH)₂ + 2H⁺ = Fe²⁺ + 2H₂O
Fe(OH)₃ Fe²⁺ + 2OH⁻ = Fe(OH)₂↓ Fe³⁺ + 3OH⁻ = Fe(OH)₃↓
4Fe(OH)₂ + O₂ + 2H₂O = 4Fe(OH)₃
(1)白 红褐 难 难 Fe(OH)₃ Fe(OH)₂ + 2H⁺ = Fe²⁺ + 2H₂O
Fe(OH)₃ Fe²⁺ + 2OH⁻ = Fe(OH)₂↓ Fe³⁺ + 3OH⁻ = Fe(OH)₃↓
4Fe(OH)₂ + O₂ + 2H₂O = 4Fe(OH)₃
[正误判断]
1. 铁和铁的氧化物都能被磁铁吸引。 (
2. $\mathrm{Fe(OH)_3}$不能利用化合反应生成。 (
3. 铝粉和三氧化二铁在高温下反应的本质是铝失电子置换出了铁,并放出大量的热。 (
4. 为防止$\mathrm{Fe(OH)_2}$被氧化,在制备时,常采用新制的$\mathrm{FeSO_4}$溶液和煮沸的$\mathrm{NaOH}$溶液制备。 (
1. 铁和铁的氧化物都能被磁铁吸引。 (
×
)2. $\mathrm{Fe(OH)_3}$不能利用化合反应生成。 (
×
)3. 铝粉和三氧化二铁在高温下反应的本质是铝失电子置换出了铁,并放出大量的热。 (
√
)4. 为防止$\mathrm{Fe(OH)_2}$被氧化,在制备时,常采用新制的$\mathrm{FeSO_4}$溶液和煮沸的$\mathrm{NaOH}$溶液制备。 (
√
)
答案:
正误判断
1.× 2.× 3.√ 4.√
1.× 2.× 3.√ 4.√
查看更多完整答案,请扫码查看


