2025年优化探究同步导学案高中化学必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年优化探究同步导学案高中化学必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第63页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
8. (2023·全国乙卷)下列应用中涉及氧化还原反
应的是 (
A.使用明矾对水进行净化
B.雪天道路上撒盐融雪
C.暖贴中的铁粉遇空气放热
D.荧光指示牌被照发光
应的是 (
C
)A.使用明矾对水进行净化
B.雪天道路上撒盐融雪
C.暖贴中的铁粉遇空气放热
D.荧光指示牌被照发光
答案:
8.C 明矾水解产生的$\mathrm{Al(OH)_3}$胶体能吸附水中的悬浮物,从而达到净水的目的,与氧化还原反应无关,A不符合题意;撒盐可降低雪的熔点,使雪融化,未发生化学变化,与氧化还原反应无关,B不符合题意;使用暖贴时,铁粉与空气中的$\mathrm{O_2}$发生氧化还原反应,C符合题意;荧光指示牌被照发光是由于电子的跃迁,与氧化还原反应无关,D不符合题意。
9. (2021·湖南卷)$ KIO_3$常用作食盐中的补碘
剂,可用“氯酸钾氧化法”制备,该方法的第一步反
应为$6 I_2 +11 KClO_3 +3 H_2 O\xlongequal{\triangle}6 KH(IO_3)_2 +5 KCl+3 Cl_2\uparrow$。下列说法错误的是 (
A.产生$22.4\ {L}$(标准状况)$ Cl_2$时,反应中转移
$10\ {mol}\ e^-$
B.反应中氧化剂和还原剂的物质的量之比为
$11:6$
C.可用石灰乳吸收反应产生的$ Cl_2$来制备漂
白粉
D.可用酸化的淀粉碘化钾溶液检验食盐中$ IO_3^-$
的存在
剂,可用“氯酸钾氧化法”制备,该方法的第一步反
应为$6 I_2 +11 KClO_3 +3 H_2 O\xlongequal{\triangle}6 KH(IO_3)_2 +5 KCl+3 Cl_2\uparrow$。下列说法错误的是 (
A
)A.产生$22.4\ {L}$(标准状况)$ Cl_2$时,反应中转移
$10\ {mol}\ e^-$
B.反应中氧化剂和还原剂的物质的量之比为
$11:6$
C.可用石灰乳吸收反应产生的$ Cl_2$来制备漂
白粉
D.可用酸化的淀粉碘化钾溶液检验食盐中$ IO_3^-$
的存在
答案:
9.A A项,根据题给化学方程式,还原剂为$\mathrm{I_2}$,$6\ \mathrm{mol\ I_2}$参加反应,转移$60\ \mathrm{mol\ e^-}$,则产生$1\ \mathrm{mol\ Cl_2}$时转移$20\ \mathrm{mol\ e^-}$,错误;B项,反应中氧化剂为$\mathrm{KClO_3}$,还原剂为$\mathrm{I_2}$,物质的量之比等于化学计量数之比,为$11:6$,正确;C项,工业上将$\mathrm{Cl_2}$通入石灰乳中制漂白粉,正确;D项,$\mathrm{IO_3^-}$与酸化的淀粉碘化钾溶液发生反应$\mathrm{5I^-+IO_3^-+6H^+=3I_2+3H_2O}$,淀粉遇单质碘变蓝,能检验$\mathrm{IO_3^-}$是否存在,正确。
10. (2021·山东卷,改编)实验室中利用固体$ KMnO_4$
进行如图实验,下列说法错误的是 (

A.G 与 H 均为氧化产物
B.实验中$ KMnO_4$只作氧化剂
C.Mn 元素至少参与了 3 个氧化还原反应
D.G 与 H 的物质的量之和之小于$0.25\ {mol}$
进行如图实验,下列说法错误的是 (
B
)
A.G 与 H 均为氧化产物
B.实验中$ KMnO_4$只作氧化剂
C.Mn 元素至少参与了 3 个氧化还原反应
D.G 与 H 的物质的量之和之小于$0.25\ {mol}$
答案:
10.B 加热$\mathrm{KMnO_4}$固体的反应中,$O$元素化合价由$-2$价升高至$0$价,被氧化,加热$\mathrm{K_2MnO_4、MnO_2}$与浓盐酸的反应中,$Cl$元素化合价由$-1$价升高至$0$价,被氧化,因此$O_2$和$Cl_2$均为氧化产物,A正确;$\mathrm{KMnO_4}$固体受热分解过程中,$Mn$元素化合价降低被还原,部分$O$元素化合价升高被氧化,因此$\mathrm{KMnO_4}$既是氧化剂也是还原剂,B错误;$Mn$元素在反应过程中物质及化合价变化为 $\mathrm{K_2MnO_4\xrightarrow[加热]{+6}KMnO_4\xrightarrow[加热]{+7}MnO_2\xrightarrow[浓盐酸、加热]{+4}MnCl_2}$至少参加了$3$个氧化还原反应,C正确;每生成$1\ \mathrm{mol\ O_2}$转移$4\ \mathrm{mol}$电子,每生成$1\ \mathrm{mol\ Cl_2}$转移$2\ \mathrm{mol}$电子,若$\mathrm{KMnO_4}$转化为$\mathrm{MnCl_2}$过程中得到的电子全部是$Cl^-$生成$Cl_2$所失去的,则气体的物质的量最大,由$\mathrm{2KMnO_4~5Cl_2}$可知,$n( 气体)_{ max}=0.25\ \mathrm{mol}$,但该气体中一定含有$O_2$,因此最终所得气体的物质的量小于$0.25\ \mathrm{mol}$,D正确。
$\mathrm{K_2MnO_4\xrightarrow[加热]{+6}KMnO_4\xrightarrow[加热]{+7}MnO_2\xrightarrow[浓盐酸、加热]{+4}MnCl_2}$至少参加了$3$个氧化还原反应,C正确;每生成$1\ \mathrm{mol\ O_2}$转移$4\ \mathrm{mol}$电子,每生成$1\ \mathrm{mol\ Cl_2}$转移$2\ \mathrm{mol}$电子,若$\mathrm{KMnO_4}$转化为$\mathrm{MnCl_2}$过程中得到的电子全部是$Cl^-$生成$Cl_2$所失去的,则气体的物质的量最大,由$\mathrm{2KMnO_4~5Cl_2}$可知,$n( 气体)_{ max}=0.25\ \mathrm{mol}$,但该气体中一定含有$O_2$,因此最终所得气体的物质的量小于$0.25\ \mathrm{mol}$,D正确。
10.B 加热$\mathrm{KMnO_4}$固体的反应中,$O$元素化合价由$-2$价升高至$0$价,被氧化,加热$\mathrm{K_2MnO_4、MnO_2}$与浓盐酸的反应中,$Cl$元素化合价由$-1$价升高至$0$价,被氧化,因此$O_2$和$Cl_2$均为氧化产物,A正确;$\mathrm{KMnO_4}$固体受热分解过程中,$Mn$元素化合价降低被还原,部分$O$元素化合价升高被氧化,因此$\mathrm{KMnO_4}$既是氧化剂也是还原剂,B错误;$Mn$元素在反应过程中物质及化合价变化为
 $\mathrm{K_2MnO_4\xrightarrow[加热]{+6}KMnO_4\xrightarrow[加热]{+7}MnO_2\xrightarrow[浓盐酸、加热]{+4}MnCl_2}$至少参加了$3$个氧化还原反应,C正确;每生成$1\ \mathrm{mol\ O_2}$转移$4\ \mathrm{mol}$电子,每生成$1\ \mathrm{mol\ Cl_2}$转移$2\ \mathrm{mol}$电子,若$\mathrm{KMnO_4}$转化为$\mathrm{MnCl_2}$过程中得到的电子全部是$Cl^-$生成$Cl_2$所失去的,则气体的物质的量最大,由$\mathrm{2KMnO_4~5Cl_2}$可知,$n( 气体)_{ max}=0.25\ \mathrm{mol}$,但该气体中一定含有$O_2$,因此最终所得气体的物质的量小于$0.25\ \mathrm{mol}$,D正确。
$\mathrm{K_2MnO_4\xrightarrow[加热]{+6}KMnO_4\xrightarrow[加热]{+7}MnO_2\xrightarrow[浓盐酸、加热]{+4}MnCl_2}$至少参加了$3$个氧化还原反应,C正确;每生成$1\ \mathrm{mol\ O_2}$转移$4\ \mathrm{mol}$电子,每生成$1\ \mathrm{mol\ Cl_2}$转移$2\ \mathrm{mol}$电子,若$\mathrm{KMnO_4}$转化为$\mathrm{MnCl_2}$过程中得到的电子全部是$Cl^-$生成$Cl_2$所失去的,则气体的物质的量最大,由$\mathrm{2KMnO_4~5Cl_2}$可知,$n( 气体)_{ max}=0.25\ \mathrm{mol}$,但该气体中一定含有$O_2$,因此最终所得气体的物质的量小于$0.25\ \mathrm{mol}$,D正确。 11. (2021·全国甲卷)碘(紫黑色固体,微溶于水)
及其化合物广泛用于医药、染料等方面。回答
下列问题:
(1)$ I_2$的一种制备方法如下图所示:
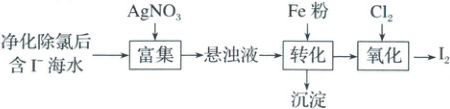
①加入 Fe 粉进行转化反应的离子方程式为
生成的沉淀与硝酸反应,生成
用。
②通入$ Cl_2$的过程中,若氧化产物只有一种,
反应的化学方程式为
物用量比$n( Cl_2)/n( FeI_2)=1.5$时,氧化产物
为
单质碘的收率会降低,原因是
(2)以$ NaIO_3$为原料制备$ I_2$的方法是先向
$ NaIO_3$溶液中加入计量的$ NaHSO_3$,生成碘化
物;再向混合溶液中加入$ NaIO_3$溶液,反应得到
$ I_2$。上述制备$ I_2$的总反应的离子方程式
为
(3)$ KI$溶液和$ CuSO_4$溶液混合可生成$ CuI$沉淀
和$ I_2$,若生成$1\ {mol}\ I_2$,消耗的$ KI$至少为
溶液反应后,过滤,滤液经水蒸气蒸馏可制得高
纯碘。反应中加入过量$ KI$的原因是
及其化合物广泛用于医药、染料等方面。回答
下列问题:
(1)$ I_2$的一种制备方法如下图所示:

①加入 Fe 粉进行转化反应的离子方程式为
$\mathrm{2AgI+Fe=2Ag+Fe^{2+}+2I^-}$
,生成的沉淀与硝酸反应,生成
$\mathrm{AgNO_3}$
后可循环使用。
②通入$ Cl_2$的过程中,若氧化产物只有一种,
反应的化学方程式为
$\mathrm{FeI_2+Cl_2=I_2+FeCl_2}$
;若反应物用量比$n( Cl_2)/n( FeI_2)=1.5$时,氧化产物
为
$\mathrm{I_2、FeCl_3}$
;当$n( Cl_2)/n( FeI_2)>1.5$后,单质碘的收率会降低,原因是
$\mathrm{I_2}$被过量的$\mathrm{Cl_2}$进一步氧化
。(2)以$ NaIO_3$为原料制备$ I_2$的方法是先向
$ NaIO_3$溶液中加入计量的$ NaHSO_3$,生成碘化
物;再向混合溶液中加入$ NaIO_3$溶液,反应得到
$ I_2$。上述制备$ I_2$的总反应的离子方程式
为
$\mathrm{2IO_3^-+5HSO_3^-=I_2+5SO_4^{2-}+H_2O+3H^+}$
。(3)$ KI$溶液和$ CuSO_4$溶液混合可生成$ CuI$沉淀
和$ I_2$,若生成$1\ {mol}\ I_2$,消耗的$ KI$至少为
4
${mol}$。$ I_2$在$ KI$溶液中可发生反应:$ I_2 + I^-\rightleftharpoons I_3^-$。实验室中使用过量的$ KI$与$ CuSO_4$溶液反应后,过滤,滤液经水蒸气蒸馏可制得高
纯碘。反应中加入过量$ KI$的原因是
防止单质碘析出
。
答案:
11.答案:
(1)①$\mathrm{2AgI+Fe=2Ag+Fe^{2+}+2I^-}$
$\mathrm{AgNO_3}$
②$\mathrm{FeI_2+Cl_2=I_2+FeCl_2}$ $\mathrm{I_2、FeCl_3}$ $\mathrm{I_2}$被过量的$\mathrm{Cl_2}$进一步氧化
(2)$\mathrm{2IO_3^-+5HSO_3^-=I_2+5SO_4^{2-}+H_2O+3H^+}$
(3)4 防止单质碘析出
解析:
(1)①结合题给流程图可知,加入$\mathrm{AgNO_3}$“富集”后得到$\mathrm{AgI}$悬浊液,加入$\mathrm{Fe}$粉后发生反应生成$\mathrm{Ag}$,离子方程式为$\mathrm{Fe+2AgI=Fe^{2+}+2I^-+2Ag}$。“沉淀”为$\mathrm{Ag}$,与$\mathrm{HNO_3}$反应生成$\mathrm{AgNO_3}$,可返回“富集”中循环使用。
②“转化”后溶液中主要存在$\mathrm{FeI_2}$,$\mathrm{Fe^{2+}}$和$\mathrm{I^-}$均可以被$\mathrm{Cl_2}$氧化,还原性:$\mathrm{I^->Fe^{2+}}$,则$\mathrm{I^-}$先于$\mathrm{Fe^{2+}}$被氧化,若氧化产物只有一种,发生反应$\mathrm{Cl_2+FeI_2=I_2+FeCl_2}$,若氧化产物有两种,发生反应$\mathrm{3Cl_2+2FeI_2=2FeCl_3+2I_2}$;当$\frac{n(\mathrm{Cl_2})}{n(\mathrm{FeI_2})}=1.5$时,恰好完全将$\mathrm{Fe^{2+}}$与$\mathrm{I^-}$氧化,故氧化产物为$\mathrm{FeCl_3、I_2}$;当$\frac{n(\mathrm{Cl_2})}{n(\mathrm{FeI_2})}>1.5$后,$\mathrm{Cl_2}$过量,$\mathrm{I_2}$会进一步被$\mathrm{Cl_2}$氧化,故单质碘的收率会降低。
(2)结合题给信息:第一步为$\mathrm{IO_3^-+3HSO_3^-=I^-+3SO_4^{2-}+3H^+}$,第二步为$\mathrm{6H^++5I^-+IO_3^-=3I_2+3H_2O}$,总反应为$\mathrm{2IO_3^-+5HSO_3^-=I_2+H_2O+3H^++5SO_4^{2-}}$。
(3)结合题给信息可知发生反应$\mathrm{2Cu^{2+}+4I^-=2CuI+I_2}$,生成$1\ \mathrm{mol\ I_2}$时,消耗$4\ \mathrm{mol\ KI}$;由题给信息知$\mathrm{I_2}$微溶于水,为防止单质碘析出,应加入过量的$\mathrm{KI}$,将$\mathrm{I_2}$转化为$\mathrm{I_3^-}$。
(1)①$\mathrm{2AgI+Fe=2Ag+Fe^{2+}+2I^-}$
$\mathrm{AgNO_3}$
②$\mathrm{FeI_2+Cl_2=I_2+FeCl_2}$ $\mathrm{I_2、FeCl_3}$ $\mathrm{I_2}$被过量的$\mathrm{Cl_2}$进一步氧化
(2)$\mathrm{2IO_3^-+5HSO_3^-=I_2+5SO_4^{2-}+H_2O+3H^+}$
(3)4 防止单质碘析出
解析:
(1)①结合题给流程图可知,加入$\mathrm{AgNO_3}$“富集”后得到$\mathrm{AgI}$悬浊液,加入$\mathrm{Fe}$粉后发生反应生成$\mathrm{Ag}$,离子方程式为$\mathrm{Fe+2AgI=Fe^{2+}+2I^-+2Ag}$。“沉淀”为$\mathrm{Ag}$,与$\mathrm{HNO_3}$反应生成$\mathrm{AgNO_3}$,可返回“富集”中循环使用。
②“转化”后溶液中主要存在$\mathrm{FeI_2}$,$\mathrm{Fe^{2+}}$和$\mathrm{I^-}$均可以被$\mathrm{Cl_2}$氧化,还原性:$\mathrm{I^->Fe^{2+}}$,则$\mathrm{I^-}$先于$\mathrm{Fe^{2+}}$被氧化,若氧化产物只有一种,发生反应$\mathrm{Cl_2+FeI_2=I_2+FeCl_2}$,若氧化产物有两种,发生反应$\mathrm{3Cl_2+2FeI_2=2FeCl_3+2I_2}$;当$\frac{n(\mathrm{Cl_2})}{n(\mathrm{FeI_2})}=1.5$时,恰好完全将$\mathrm{Fe^{2+}}$与$\mathrm{I^-}$氧化,故氧化产物为$\mathrm{FeCl_3、I_2}$;当$\frac{n(\mathrm{Cl_2})}{n(\mathrm{FeI_2})}>1.5$后,$\mathrm{Cl_2}$过量,$\mathrm{I_2}$会进一步被$\mathrm{Cl_2}$氧化,故单质碘的收率会降低。
(2)结合题给信息:第一步为$\mathrm{IO_3^-+3HSO_3^-=I^-+3SO_4^{2-}+3H^+}$,第二步为$\mathrm{6H^++5I^-+IO_3^-=3I_2+3H_2O}$,总反应为$\mathrm{2IO_3^-+5HSO_3^-=I_2+H_2O+3H^++5SO_4^{2-}}$。
(3)结合题给信息可知发生反应$\mathrm{2Cu^{2+}+4I^-=2CuI+I_2}$,生成$1\ \mathrm{mol\ I_2}$时,消耗$4\ \mathrm{mol\ KI}$;由题给信息知$\mathrm{I_2}$微溶于水,为防止单质碘析出,应加入过量的$\mathrm{KI}$,将$\mathrm{I_2}$转化为$\mathrm{I_3^-}$。
查看更多完整答案,请扫码查看


