2025年优化探究同步导学案高中化学必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年优化探究同步导学案高中化学必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第18页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
[正误判断]
1. 配制溶液时,可以用托盘天平称取$10\ g$固体溶质。 (
2. 配制溶液时,可以把固体直接放入容量瓶中,加蒸馏水溶解。 (
3. 定容时,眼睛应平视凹液面与刻度线相切。 (
4. 配制一定物质的量浓度的稀盐酸时,用量筒量取$9.82\ mL$浓盐酸。 (
5. 称量$NaCl$固体和$NaOH$固体都可以用称量纸。 (
1. 配制溶液时,可以用托盘天平称取$10\ g$固体溶质。 (
×
)2. 配制溶液时,可以把固体直接放入容量瓶中,加蒸馏水溶解。 (
×
)3. 定容时,眼睛应平视凹液面与刻度线相切。 (
√
)4. 配制一定物质的量浓度的稀盐酸时,用量筒量取$9.82\ mL$浓盐酸。 (
×
)5. 称量$NaCl$固体和$NaOH$固体都可以用称量纸。 (
×
)
答案:
1.× 2.× 3.√ 4.× 5.×
实验室需要配制$480\ mL\ 1.00\ mol· L^{-1}$的氢氧化钠溶液,则用托盘天平称量多少克氢氧化钠固体?
提示:配制氢氧化钠溶液$480\ \mathrm{mL}$,需要容量瓶的容积为$500\ \mathrm{mL}$。则计算应按照$500\ \mathrm{mL}(0.5\ \mathrm{L})$计算。则$n = c· V = 1.00\ \mathrm{mol· L^{-1}}×0.5\ \mathrm{L}=0.5\ \mathrm{mol}$,$m = n· M = 0.5\ \mathrm{mol}×40\ \mathrm{g· mol^{-1}} = 20.0\ \mathrm{g}$。
答案:
提示:配制氢氧化钠溶液$480\ \mathrm{mL}$,需要容量瓶的容积为$500\ \mathrm{mL}$。则计算应按照$500\ \mathrm{mL}(0.5\ \mathrm{L})$计算。则$n = c· V = 1.00\ \mathrm{mol· L^{-1}}×0.5\ \mathrm{L}=0.5\ \mathrm{mol}$,$m = n· M = 0.5\ \mathrm{mol}×40\ \mathrm{g· mol^{-1}} = 20.0\ \mathrm{g}$。
1. 要配制$1\ L\ 0.1\ mol· L^{-1}\ CuSO_{4}$溶液:
(1) 若用$CuSO_{4}$配制,需要$CuSO_{4}$粉末的质量为
(2) 若用$CuSO_{4}· 5H_{2}O$配制,需要$CuSO_{4}· 5H_{2}O$的质量为
(1) 若用$CuSO_{4}$配制,需要$CuSO_{4}$粉末的质量为
$16.0\ \mathrm{g}$
;(2) 若用$CuSO_{4}· 5H_{2}O$配制,需要$CuSO_{4}· 5H_{2}O$的质量为
$25.0\ \mathrm{g}$
。
答案:
1.答案:
(1)$16.0\ \mathrm{g}$
(2)$25.0\ \mathrm{g}$
解析:$1\ \mathrm{L}\ 0.1\ \mathrm{mol· L^{-1}}\ \mathrm{CuSO_{4}}$溶液,溶质$\mathrm{CuSO_{4}}$的物质的量$n = 1\ \mathrm{L}×0.1\ \mathrm{mol· L^{-1}} = 0.1\ \mathrm{mol}$。
(1)需要$\mathrm{CuSO_{4}}$粉末质量为$0.1\ \mathrm{mol}×160\ \mathrm{g· mol^{-1}} = 16.0\ \mathrm{g}$。
(2)需要$\mathrm{CuSO_{4}·5H_{2}O}$的质量为$0.1\ \mathrm{mol}×250\ \mathrm{g· mol^{-1}} = 25.0\ \mathrm{g}$。
(1)$16.0\ \mathrm{g}$
(2)$25.0\ \mathrm{g}$
解析:$1\ \mathrm{L}\ 0.1\ \mathrm{mol· L^{-1}}\ \mathrm{CuSO_{4}}$溶液,溶质$\mathrm{CuSO_{4}}$的物质的量$n = 1\ \mathrm{L}×0.1\ \mathrm{mol· L^{-1}} = 0.1\ \mathrm{mol}$。
(1)需要$\mathrm{CuSO_{4}}$粉末质量为$0.1\ \mathrm{mol}×160\ \mathrm{g· mol^{-1}} = 16.0\ \mathrm{g}$。
(2)需要$\mathrm{CuSO_{4}·5H_{2}O}$的质量为$0.1\ \mathrm{mol}×250\ \mathrm{g· mol^{-1}} = 25.0\ \mathrm{g}$。
2. 下列有关一定物质的量浓度溶液的配制说法不正确的是
(1) 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至液面离刻度线以下$1\sim2\ cm$时,改用胶头滴管滴加蒸馏水至液体的凹液面与容量瓶刻度线相切;
(2) 利用图 a 配制一定物质的量浓度的$NaOH$溶液;
(3) 利用图 b 配制一定物质的量浓度的$NaCl$溶液;
(4) 用容量瓶配制溶液时,若加水超过刻度线,立即用胶头滴管吸出多余液体;
(5) 配制溶液的定容操作可以用图 c 表示。
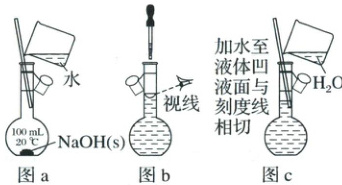
(2)(3)(4)(5)
(填序号)。(1) 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至液面离刻度线以下$1\sim2\ cm$时,改用胶头滴管滴加蒸馏水至液体的凹液面与容量瓶刻度线相切;
(2) 利用图 a 配制一定物质的量浓度的$NaOH$溶液;
(3) 利用图 b 配制一定物质的量浓度的$NaCl$溶液;
(4) 用容量瓶配制溶液时,若加水超过刻度线,立即用胶头滴管吸出多余液体;
(5) 配制溶液的定容操作可以用图 c 表示。

答案:
2.答案:
(2)
(3)
(4)
(5)
@@解析:
(2)使用容量瓶配制溶液时,容量瓶不能直接溶解固体,错误;
(3)定容时,视线要与凹液面最低点相切,错误;
(4)用容量瓶配制溶液时,若加水超过刻度线,应重新配制溶液,错误;
(5)定容时,液面距刻度线以下$1\sim2\ \mathrm{cm}$时应改用胶头滴管继续滴加至液体凹液面与刻度线相切,错误。
(2)
(3)
(4)
(5)
@@解析:
(2)使用容量瓶配制溶液时,容量瓶不能直接溶解固体,错误;
(3)定容时,视线要与凹液面最低点相切,错误;
(4)用容量瓶配制溶液时,若加水超过刻度线,应重新配制溶液,错误;
(5)定容时,液面距刻度线以下$1\sim2\ \mathrm{cm}$时应改用胶头滴管继续滴加至液体凹液面与刻度线相切,错误。
1. 误差分析的原理依据
根据$c_{B} = \frac{n_{B}}{V} = \frac{m_{B}}{M_{B}V}$可知,$M_{B}$为定值(溶质的摩尔质量),实验过程中不规范的操作会导致
的值发生变化,从而使所配制溶液的物质的量浓度产生误差。
(1) 其他条件不变时,$n_{B}$、$m_{B}$增大(或减小),$c_{B}$
(2) 其他条件不变时,$V$增大(或减小),$c_{B}$
根据$c_{B} = \frac{n_{B}}{V} = \frac{m_{B}}{M_{B}V}$可知,$M_{B}$为定值(溶质的摩尔质量),实验过程中不规范的操作会导致
$m_{\mathrm{B}}$或$V$
的值发生变化,从而使所配制溶液的物质的量浓度产生误差。
(1) 其他条件不变时,$n_{B}$、$m_{B}$增大(或减小),$c_{B}$
偏大
(或偏小
)(填$``$偏大$"$或$``$偏小$"$,下同)。(2) 其他条件不变时,$V$增大(或减小),$c_{B}$
偏小
(或偏大
)。
答案:
1.$m_{\mathrm{B}}$或$V$
(1)偏大 偏小
(2)偏小 偏大
(1)偏大 偏小
(2)偏小 偏大
2. 配制一定物质的量浓度溶液的误差分析
(1) 容量瓶定容时仰视、俯视对溶液的浓度产生影响

①仰视刻度线(如图 a):加水量高于刻度线,溶液体积偏大,$c$
②俯视刻度线(如图 b):加水量低于刻度线,溶液体积偏小,$c$
(2) 配制一定物质的量浓度的稀硫酸时,用量筒量取一定体积的浓硫酸时仰视、俯视对溶液的浓度产生影响
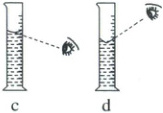
①仰视刻度线(如图 c):浓硫酸的体积偏大,即溶液中的溶质硫酸偏多,$c$
②俯视刻度线(如图 d):浓硫酸的体积偏小,即溶液中的溶质硫酸偏少,$c$
(1) 容量瓶定容时仰视、俯视对溶液的浓度产生影响

①仰视刻度线(如图 a):加水量高于刻度线,溶液体积偏大,$c$
偏小
。②俯视刻度线(如图 b):加水量低于刻度线,溶液体积偏小,$c$
偏大
。(2) 配制一定物质的量浓度的稀硫酸时,用量筒量取一定体积的浓硫酸时仰视、俯视对溶液的浓度产生影响

①仰视刻度线(如图 c):浓硫酸的体积偏大,即溶液中的溶质硫酸偏多,$c$
偏大
。②俯视刻度线(如图 d):浓硫酸的体积偏小,即溶液中的溶质硫酸偏少,$c$
偏小
。
答案:
2.
(1)偏小 偏大
(2)偏大 偏小
(1)偏小 偏大
(2)偏大 偏小
查看更多完整答案,请扫码查看


