2025年优化探究同步导学案高中化学必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年优化探究同步导学案高中化学必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第53页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1.已知$X_2O_7^{2-}$能将$SO_3^{2-}$氧化,当溶液中$X_2O_7^{2-}$与$SO_3^{2-}$物质的量之比为 1:3时,$SO_3^{2-}$恰好被氧化为$SO_4^{2-}$,计算X在还原产物中的化合价。
“找物质”:$X₂O₇²⁻$在反应中是氧化剂,$SO₃²⁻$是还原剂,$SO₄²⁻$是氧化产物。
“定得失”:假设X在还原产物中的化合价为+n价,则1个$X₂O₇²⁻$在反应中得到2×(6−n)个电子,一个$SO₃²⁻→SO₄²⁻$过程中失去2个电子。
“列关系”:N(氧化剂)×变价原子个数×化合价变化值=N (还原剂)×变价原子个数×化合价变化值。根据上述分析列出得失电子守恒等式:1×2×(6−n)=3×2,解得n=3。
即X在还原产物中的化合价为+3。
“定得失”:假设X在还原产物中的化合价为+n价,则1个$X₂O₇²⁻$在反应中得到2×(6−n)个电子,一个$SO₃²⁻→SO₄²⁻$过程中失去2个电子。
“列关系”:N(氧化剂)×变价原子个数×化合价变化值=N (还原剂)×变价原子个数×化合价变化值。根据上述分析列出得失电子守恒等式:1×2×(6−n)=3×2,解得n=3。
即X在还原产物中的化合价为+3。
答案:
1.提示:“找物质”:$X₂O₇²⁻$在反应中是氧化剂,$SO₃²⁻$是还原剂,$SO₄²⁻$是氧化产物。
“定得失”:假设X在还原产物中的化合价为+n价,则1个$X₂O₇²⁻$在反应中得到2×(6−n)个电子,一个$SO₃²⁻→SO₄²⁻$过程中失去2个电子。
“列关系”:N(氧化剂)×变价原子个数×化合价变化值=N (还原剂)×变价原子个数×化合价变化值。根据上述分析列出得失电子守恒等式:1×2×(6−n)=3×2,解得n=3。
即X在还原产物中的化合价为+3。
“定得失”:假设X在还原产物中的化合价为+n价,则1个$X₂O₇²⁻$在反应中得到2×(6−n)个电子,一个$SO₃²⁻→SO₄²⁻$过程中失去2个电子。
“列关系”:N(氧化剂)×变价原子个数×化合价变化值=N (还原剂)×变价原子个数×化合价变化值。根据上述分析列出得失电子守恒等式:1×2×(6−n)=3×2,解得n=3。
即X在还原产物中的化合价为+3。
2.配平$C + HNO_3(浓)\longrightarrow NO_2\uparrow + CO_2\uparrow +H_2O$。
配平一般步骤
①标价态:写出反应物和生成物的化学式,标出发生氧化反应和还原反应的元素的化合价。
$C⁰+HNO₃⁺⁵(浓)→NO₂⁺⁴↑+CO₂⁺⁴↑+H₂O$
②列变化:标出反应前后元素化合价的变化。

$C⁰+HNO₃⁺⁵(浓)→NO₂⁺⁴↑+CO₂⁺⁴↑+H₂O$
化合价升高4
化合价降低1
③求总数:依据得失电子守恒,使化合价升高和降低的总数相等。

$C⁰+4HNO₃⁺⁵(浓)→4NO₂⁺⁴↑+CO₂⁺⁴↑+H₂O$
化合价升高,失去4e⁻×1
化合价降低,得到1e⁻×4
④配系数:用观察法配平其他物质的化学计量数。
$C+4HNO₃(浓)→4NO₂↑+CO₂↑+2H₂O$
⑤查守恒:检查电荷是否守恒,原子个数是否守恒。
$C+4HNO₃(浓)\triangle→4NO₂↑+CO₂↑+2H₂O$
。①标价态:写出反应物和生成物的化学式,标出发生氧化反应和还原反应的元素的化合价。
$C⁰+HNO₃⁺⁵(浓)→NO₂⁺⁴↑+CO₂⁺⁴↑+H₂O$
②列变化:标出反应前后元素化合价的变化。

$C⁰+HNO₃⁺⁵(浓)→NO₂⁺⁴↑+CO₂⁺⁴↑+H₂O$
化合价升高4
化合价降低1
③求总数:依据得失电子守恒,使化合价升高和降低的总数相等。

$C⁰+4HNO₃⁺⁵(浓)→4NO₂⁺⁴↑+CO₂⁺⁴↑+H₂O$
化合价升高,失去4e⁻×1
化合价降低,得到1e⁻×4
④配系数:用观察法配平其他物质的化学计量数。
$C+4HNO₃(浓)→4NO₂↑+CO₂↑+2H₂O$
⑤查守恒:检查电荷是否守恒,原子个数是否守恒。
$C+4HNO₃(浓)\triangle→4NO₂↑+CO₂↑+2H₂O$
答案:
2.提示:配平一般步骤
①标价态:写出反应物和生成物的化学式,标出发生氧化反应和还原反应的元素的化合价。
$C⁰+HNO₃⁺⁵(浓)→NO₂⁺⁴↑+CO₂⁺⁴↑+H₂O$
②列变化:标出反应前后元素化合价的变化。

$C⁰+HNO₃⁺⁵(浓)→NO₂⁺⁴↑+CO₂⁺⁴↑+H₂O$
化合价升高4
化合价降低1
③求总数:依据得失电子守恒,使化合价升高和降低的总数相等。

$C⁰+4HNO₃⁺⁵(浓)→4NO₂⁺⁴↑+CO₂⁺⁴↑+H₂O$
化合价升高,失去4e⁻×1
化合价降低,得到1e⁻×4
④配系数:用观察法配平其他物质的化学计量数。
$C+4HNO₃(浓)→4NO₂↑+CO₂↑+2H₂O$
⑤查守恒:检查电荷是否守恒,原子个数是否守恒。
$C+4HNO₃(浓)\triangle→4NO₂↑+CO₂↑+2H₂O$
2.提示:配平一般步骤
①标价态:写出反应物和生成物的化学式,标出发生氧化反应和还原反应的元素的化合价。
$C⁰+HNO₃⁺⁵(浓)→NO₂⁺⁴↑+CO₂⁺⁴↑+H₂O$
②列变化:标出反应前后元素化合价的变化。

$C⁰+HNO₃⁺⁵(浓)→NO₂⁺⁴↑+CO₂⁺⁴↑+H₂O$
化合价升高4
化合价降低1
③求总数:依据得失电子守恒,使化合价升高和降低的总数相等。

$C⁰+4HNO₃⁺⁵(浓)→4NO₂⁺⁴↑+CO₂⁺⁴↑+H₂O$
化合价升高,失去4e⁻×1
化合价降低,得到1e⁻×4
④配系数:用观察法配平其他物质的化学计量数。
$C+4HNO₃(浓)→4NO₂↑+CO₂↑+2H₂O$
⑤查守恒:检查电荷是否守恒,原子个数是否守恒。
$C+4HNO₃(浓)\triangle→4NO₂↑+CO₂↑+2H₂O$
1.(2024·石家庄一中高一期末)一定条件下,当溶液中$XO_4^-$与$H_2O_2$分子个数比恰好为 2:5时,溶液中$XO_4^-$被还原为较低价态,则X元素的化合价为 (
A.+2
B.+3
C.+4
D.+5
A
)A.+2
B.+3
C.+4
D.+5
答案:
1.A $XO₄⁻$中X元素的化合价为+7,一定条件下,当溶液中$XO₄⁻$与$H₂O₂$分子个数比恰好为2:5时,溶液中$XO₄⁻$被还原为较低价态,$H₂O₂$被氧化为$O₂$,设还原产物中X元素的化合价为a,根据得失电子守恒(7−a)×2=2×5,a=+2。
2.(2024·福建南平高一期末)$Cl_2$与强碱溶液反应时,它的产物取决于强碱溶液的温度。一定条件下足量$Cl_2$与$NaOH$溶液完全反应,测得溶液中$ClO^-$、$ClO_3^-$物质的量之比为 6:1,则溶液中$Cl^-$和$ClO^-$物质的量之比为 (
A.2:1
B.5:1
C.8:3
D.11:6
D
)A.2:1
B.5:1
C.8:3
D.11:6
答案:
2.D $ClO⁻$、$ClO₃⁻$物质的量之比为6:1,则不妨设$n(ClO⁻)=6mol$,$n(ClO₃⁻)=1mol$,根据得失电子守恒可得:$n(Cl⁻)=n(ClO⁻)+5n(ClO₃⁻)=6mol + 5mol = 11mol$,则溶液中$Cl⁻$和$ClO⁻$物质的量之比为11:6。
3.(2024·浙江杭州高一期末)把图 b的碎纸片补充到图 a中,可得到一个完整的氧化还原型离子方程式,下列有关该方程式的说法正确的是 (
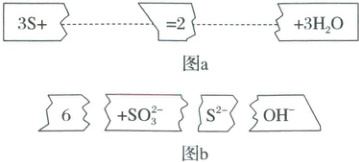
A.配平后的化学计量数依次为 3、1、2、6、3
B.氧化剂与还原剂的物质的量之比为 1:2
C.每生成 3 分子$H_2O$,转移电子数为 4个
D.$SO_3^{2-}$是还原产物
C
)
A.配平后的化学计量数依次为 3、1、2、6、3
B.氧化剂与还原剂的物质的量之比为 1:2
C.每生成 3 分子$H_2O$,转移电子数为 4个
D.$SO_3^{2-}$是还原产物
答案:
3.C 由图可知,硫是反应物,则题给反应为硫与溶液中的氢氧根离子反应生成硫离子、亚硫酸根离子和水,反应的离子方程式为$3S + 6OH⁻ = 2S²⁻ + SO₃²⁻ + 3H₂O$,反应中硫元素的化合价既升高被氧化又降低被还原,硫既是反应的氧化剂也是还原剂,硫离子是反应的还原产物、亚硫酸根离子是氧化产物。A.配平后的化学计量数依次为3、6、2、1、3,故A 错误;B.硫既是反应的氧化剂也是还原剂,硫离子是反应的还原产物、亚硫酸根离子是氧化产物,则由方程式可知,氧化剂与还原剂的物质的量之比为2:1,故B错误;C.由方程式可知,反应生成3个水分子,转移电子数为4个,故C正确;D.亚硫酸根离子是氧化产物,故D错误。
查看更多完整答案,请扫码查看


