2025年同步练习册人民教育出版社高中化学选择性必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第97页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
一、金属键与金属晶体
1. 金属键
(1) 定义:在金属晶体中_______与_______之间强烈的相互作用。
(2) 存在:_或_______。
(3) 成键粒子:_和_______。
(4) 成键本质——电子气理论:金属原子脱落下来的_______形成遍布整块晶体的“电子气”,被所有原子共用,从而把_______维系在一起,形成像共价晶体一样的“巨分子”。
2. 金属晶体
(1) 定义:金属(除_______外)在常温下都是_______,称其为金属晶体。
(2) 构成粒子:_和_______。
(3) 作用力:金属键。
(4) 用电子气理论解释金属的物理性质。
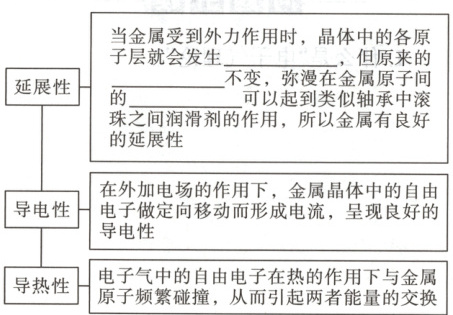
1. 金属键
(1) 定义:在金属晶体中_______与_______之间强烈的相互作用。
(2) 存在:_或_______。
(3) 成键粒子:_和_______。
(4) 成键本质——电子气理论:金属原子脱落下来的_______形成遍布整块晶体的“电子气”,被所有原子共用,从而把_______维系在一起,形成像共价晶体一样的“巨分子”。
2. 金属晶体
(1) 定义:金属(除_______外)在常温下都是_______,称其为金属晶体。
(2) 构成粒子:_和_______。
(3) 作用力:金属键。
(4) 用电子气理论解释金属的物理性质。

答案:
一、1.
(1)金属阳离子 自由电子
(2)金属单质
(3)金属阳离子 自由电子
(4)价电子 所有的金属原子
2.
(1)汞 晶体
(2)金属阳离子 自由电子
(4)相对滑动 排列方式 电子气
(1)金属阳离子 自由电子
(2)金属单质
(3)金属阳离子 自由电子
(4)价电子 所有的金属原子
2.
(1)汞 晶体
(2)金属阳离子 自由电子
(4)相对滑动 排列方式 电子气
二、离子晶体
1. 离子晶体
(1) 定义:由
(2) 构成粒子:_和
(3) 作用力:离子键。
2. 常见的离子晶体
(1) 单原子
(2) 存在
(3) 存在电中性分子的离子晶体,如CuSO₄·5H₂O等。
3. 物理性质
(1) 硬度
(2) 熔点和沸点
(3) 固体不导电,但在
1. 离子晶体
(1) 定义:由
阳离子
和阴离子
相互作用而形成的晶体。(2) 构成粒子:_和
阴离子
。(3) 作用力:离子键。
2. 常见的离子晶体
(1) 单原子
阴、阳
离子,如NaCl、CaF₂等。(2) 存在
共价键
的离子晶体,如NH₄Cl、K₂SO₄等。(3) 存在电中性分子的离子晶体,如CuSO₄·5H₂O等。
3. 物理性质
(1) 硬度
较大
,难于压缩。(2) 熔点和沸点
较高
。(3) 固体不导电,但在
熔融状态或水溶液中
时能导电。
答案:
二、1.
(1)阳离子 阴离子
(2)阳离子 阴离子
2.
(1)阴、阳
(2)共价键
3.
(1)较大
(2)较高
(3)熔融状态或水溶液中
(1)阳离子 阴离子
(2)阳离子 阴离子
2.
(1)阴、阳
(2)共价键
3.
(1)较大
(2)较高
(3)熔融状态或水溶液中
三、离子液体
1. 离子液体
(1) 定义:在
(2) 特点:①大多数离子液体含有体积很大的阴、阳离子;②离子液体
(3) 应用:①用作溶剂;②在生物化学等科研领域有广泛应用。
2. 离子液体中常见的阴、阳离子
阴离子:_离子(AlCl₄⁻)、_离子(BF₄⁻)、六氟磷酸根离子(PF₆⁻)等;
阳离子:季铵离子(R₄N⁺,即NH₄⁺中的
1. 离子液体
(1) 定义:在
室温
或稍高于室温时呈液态
的离子化合物,称为离子液体。(2) 特点:①大多数离子液体含有体积很大的阴、阳离子;②离子液体
难
挥发。(3) 应用:①用作溶剂;②在生物化学等科研领域有广泛应用。
2. 离子液体中常见的阴、阳离子
阴离子:_离子(AlCl₄⁻)、_离子(BF₄⁻)、六氟磷酸根离子(PF₆⁻)等;
阳离子:季铵离子(R₄N⁺,即NH₄⁺中的
H
被烃基R
取代)、带烃基侧链的咪唑、嘧啶等有环状含氮结构的有机胺正离子等。
答案:
三、1.
(1)室温 液态
(2)难2.四氯铝酸根 四氟硼酸根 H R
(1)室温 液态
(2)难2.四氯铝酸根 四氟硼酸根 H R
【自主思考1】金属原子是通过何种键型形成的晶体?有哪些优良性质?
答案:
[自主思考1]提示 金属原子通过金属键形成的晶体叫金属晶体。其具有优良的导电性、导热性和延展性。
【自主思考2】离子晶体是否全由金属元素与非金属元素组成?
答案:
[自主思考2]提示 不一定,如$NH_4Cl$是离子晶体,但它不含金属元素。
1. 判断正误,正确的画“√”,错误的画“×”。
(1) 常温下,金属单质都以晶体形式存在。 (
(2) 金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用。 (
(3) 金属键的强弱决定金属晶体的熔点和硬度。 (
(4) 离子晶体中含有阴、阳离子,在固态时导电。 (
(5) 固态不导电、水溶液能导电,这一性质能说明某晶体一定是离子晶体。 (
(6) 氯化钠、氟化钙晶体我们通常写为NaCl、CaF₂,说明晶体中分别存在组成为NaCl、CaF₂的分子。 (
(7) 在NaCl正六面体的晶胞的顶点上、面上、棱上的Na⁺或Cl⁻为该晶胞与其相邻的晶胞所共有,一个晶胞中Na⁺的个数为6,Cl⁻的个数为4。 (
(8) 离子液体易挥发。 (
(1) 常温下,金属单质都以晶体形式存在。 (
×
)(2) 金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用。 (
×
)(3) 金属键的强弱决定金属晶体的熔点和硬度。 (
√
)(4) 离子晶体中含有阴、阳离子,在固态时导电。 (
×
)(5) 固态不导电、水溶液能导电,这一性质能说明某晶体一定是离子晶体。 (
×
)(6) 氯化钠、氟化钙晶体我们通常写为NaCl、CaF₂,说明晶体中分别存在组成为NaCl、CaF₂的分子。 (
×
)(7) 在NaCl正六面体的晶胞的顶点上、面上、棱上的Na⁺或Cl⁻为该晶胞与其相邻的晶胞所共有,一个晶胞中Na⁺的个数为6,Cl⁻的个数为4。 (
×
)(8) 离子液体易挥发。 (
×
)
答案:
1.答案
(1)×
(2)×
(3)√
(4)×
(5)×
(6)×
(7)×
(8)×
(1)×
(2)×
(3)√
(4)×
(5)×
(6)×
(7)×
(8)×
2. 根据物质的性质,判断下列物质的晶体类型。
(1) SiI₄:熔点120.5℃,沸点271.5℃,易水解,因此该物质的晶体类型为
(2) 硼:熔点2300℃,沸点2550℃,硬度大,因此该物质的晶体类型为
(3) 硒:熔点217℃,沸点685℃,溶于氯仿,因此该物质的晶体类型为
(4) 锑:熔点630.74℃,沸点1750℃,导电,因此该物质的晶体类型为
(5) MgCl₂:熔点712℃,沸点1418℃,熔融时能导电,因此该物质的晶体类型为
(1) SiI₄:熔点120.5℃,沸点271.5℃,易水解,因此该物质的晶体类型为
分子晶体
。(2) 硼:熔点2300℃,沸点2550℃,硬度大,因此该物质的晶体类型为
共价晶体
。(3) 硒:熔点217℃,沸点685℃,溶于氯仿,因此该物质的晶体类型为
分子晶体
。(4) 锑:熔点630.74℃,沸点1750℃,导电,因此该物质的晶体类型为
金属晶体
。(5) MgCl₂:熔点712℃,沸点1418℃,熔融时能导电,因此该物质的晶体类型为
离子晶体
。
答案:
2.答案
(1)分子晶体
(2)共价晶体
(3)分子晶体
(4)金属晶体
(5)离子晶体
(1)分子晶体
(2)共价晶体
(3)分子晶体
(4)金属晶体
(5)离子晶体
查看更多完整答案,请扫码查看


