2025年同步练习册人民教育出版社高中化学选择性必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第41页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
1. 下列关于共价键的理解不正确的是(
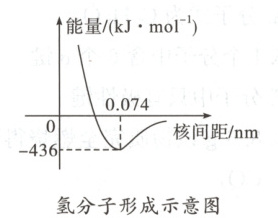
A.由上图可知氢分子中两个氢原子的核间距为 0.074 nm
B.H₂O₂分子中既有极性键又有非极性键
C.氢分子中共价键没有方向性
D.形成共价键后共用电子只在两个原子核之间出现
D
)。
A.由上图可知氢分子中两个氢原子的核间距为 0.074 nm
B.H₂O₂分子中既有极性键又有非极性键
C.氢分子中共价键没有方向性
D.形成共价键后共用电子只在两个原子核之间出现
答案:
1.D 解析由题图可知,两个氢原子相互靠近的过程中,在相距0.074nm时体系能量最低,体系最稳定,此时形成稳定的氢分子,A项正确;H₂O₂分子中既存在H—O极性键,又存在O—O非极性键,B项正确;氢分子中两个氢原子的未成对电子均为1s电子,s轨道在空间呈球形对称,故s轨道之间的重叠不具有方向性,C项正确;形成共价键后共用电子在两个原子核之间出现的概率增大,并不是只在两个原子核之间出现,D项错误。
2. 下面是从实验中测得的不同物质中氧氧键的键长和键能的数据:
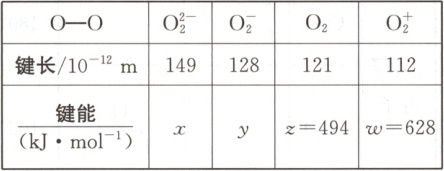
其中 x、y 的键能数据尚未测定,但可根据规律推导出键能的大小顺序为 w > z > y > x。则该规律是(
A.键长越长,键能越小
B.成键所用的电子数越多,键能越大
C.成键所用的电子数越少,键能越大
D.成键时共用电子偏移程度越大,键能越大

其中 x、y 的键能数据尚未测定,但可根据规律推导出键能的大小顺序为 w > z > y > x。则该规律是(
A
)。A.键长越长,键能越小
B.成键所用的电子数越多,键能越大
C.成键所用的电子数越少,键能越大
D.成键时共用电子偏移程度越大,键能越大
答案:
2.A 解析根据数据可知键长逐渐减小,但键能逐渐增大,可知键长越长,键能越小,A项正确。由数据可知O₂²⁻和O₂成键所用电子数都是两个,但键能x<y,说明键能大小与成键电子数无关,B、C项错误。同种元素之间形成的化学键是非极性共价键,共用电子对不偏移,D项错误。
3. 六氟化硫分子呈正八面体结构(如图所示),在高电压下仍有良好的绝缘性,性质稳定,在电器工业方面有着广泛的用途,但逸散到空气中会引起强温室效应。下列有关六氟化硫的推测正确的是(
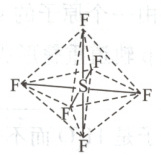
A.六氟化硫中各原子均为 8 电子稳定结构
B.六氟化硫易燃烧生成二氧化硫
C.六氟化硫分子中含极性键、非极性键
D.S—F 是 σ键,且键长、键能都相等
D
)。
A.六氟化硫中各原子均为 8 电子稳定结构
B.六氟化硫易燃烧生成二氧化硫
C.六氟化硫分子中含极性键、非极性键
D.S—F 是 σ键,且键长、键能都相等
答案:
3.D 解析根据题图知,每个F原子和1个S原子形成1对共用电子对,每个S原子和6个F原子形成6对共用电子对,所以F原子都达到8电子稳定结构,但S原子最外层达到12电子,A项错误;六氟化硫不易燃烧生成二氧化硫,B项错误;同种原子间形成非极性键,不同种原子间形成极性键,六氟化硫分子中的S—F均为极性键,不含非极性键,C项错误;六氟化硫分子中的S—F都是σ键,为正八面体结构,所以键长、键能都相等,D项正确。
4. X、Y、Z、W 是元素周期表前四周期中的四种常见元素,其相关信息如下表:

下列说法中错误的是(
A.W 位于元素周期表第四周期第ⅠB 族
B.XZ₄是一种常用的溶剂,1 个 XZ₄的分子中存在 4 个 σ键
C.键长:H—Y > H—Z
D.XY₂分子中 Y—X—Y 的键角为 120°

下列说法中错误的是(
D
)。A.W 位于元素周期表第四周期第ⅠB 族
B.XZ₄是一种常用的溶剂,1 个 XZ₄的分子中存在 4 个 σ键
C.键长:H—Y > H—Z
D.XY₂分子中 Y—X—Y 的键角为 120°
答案:
4.D 解析由题给信息推出X元素基态原子的电子排布式为1s²2s²2p²,为碳元素;Y为硫元素;Z为氯元素;W为铜元素。铜元素位于元素周期表第四周期第ⅠB族,A项正确;CCl₄是一种常用的溶剂,1个CCl₄分子中全部为单键,有4个σ键,B项正确;原子半径S>Cl,所以键长H—S>H—Cl,C项正确;XY₂为CS₂,结构式为S═C═S,空间结构与CO₂相似,键角为180°,D项错误。
5. 回答下列问题。
(1)有以下物质:A. HF B. Br₂ C. H₂O D. N₂ E. C₂H₄ F. C₂H₆ G. H₂ H. H₂O₂ I. HCN J. CO₂ K. HCHO
①只含有 σ键的是
②既含有 σ键又含有 π键的是
③含有由一个原子的 s 轨道与另一个原子的 p 轨道重叠形成的 σ键的是
④水分子是 H₂O 而不是 H₃O,是因为共价键具有
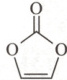
(2)碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如右图所示。下列有关该物质的说法正确的是
A.分子式为 C₃H₂O₃
B.1 个分子中含 6 个 σ键
C.分子中只有极性键
D.8.6 g 该物质完全燃烧得到 6.72 L CO₂
(1)有以下物质:A. HF B. Br₂ C. H₂O D. N₂ E. C₂H₄ F. C₂H₆ G. H₂ H. H₂O₂ I. HCN J. CO₂ K. HCHO
①只含有 σ键的是
ABCFGH
(填字母,下同);②既含有 σ键又含有 π键的是
DEIJK
;③含有由一个原子的 s 轨道与另一个原子的 p 轨道重叠形成的 σ键的是
ACEFHIK
;④水分子是 H₂O 而不是 H₃O,是因为共价键具有
饱和
性;水分子的键角接近 104.5°,是因为共价键具有方向
性。(2)碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如右图所示。下列有关该物质的说法正确的是
A
(填字母)。
A.分子式为 C₃H₂O₃
B.1 个分子中含 6 个 σ键
C.分子中只有极性键
D.8.6 g 该物质完全燃烧得到 6.72 L CO₂
答案:
5.解析
(1)根据以下两点判断化学键类型:①单键只能是σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键;②同种元素原子间形成的共价键是非极性键,不同种元素原子之间形成的共价键是极性键。共价键的方向性决定分子的空间结构,共价键的饱和性决定分子中所含有的原子的数目。
(2)由碳酸亚乙烯酯的结构及C、O原子的成键特点,可知该物质的分子式为C₃H₂O₃,A正确;分子中C═O和C═C各含有1个σ键,C—O和C—H都是σ键,故1个分子中含有8个σ键,B错误;碳酸亚乙烯酯分子中C═O、C—O和C—H都是极性键,C═C是非极性键,C错误;8.6g碳酸亚乙烯酯的物质的量为0.1mol,完全燃烧后生成0.3molCO₂,在标准状况下其体积为6.72L,但题目未指明CO₂是否处于标准状况,D错误。
答案
(1)①ABCFGH ②DEIJK ③ACEFHIK ④饱和 方向
(2)A
(1)根据以下两点判断化学键类型:①单键只能是σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键;②同种元素原子间形成的共价键是非极性键,不同种元素原子之间形成的共价键是极性键。共价键的方向性决定分子的空间结构,共价键的饱和性决定分子中所含有的原子的数目。
(2)由碳酸亚乙烯酯的结构及C、O原子的成键特点,可知该物质的分子式为C₃H₂O₃,A正确;分子中C═O和C═C各含有1个σ键,C—O和C—H都是σ键,故1个分子中含有8个σ键,B错误;碳酸亚乙烯酯分子中C═O、C—O和C—H都是极性键,C═C是非极性键,C错误;8.6g碳酸亚乙烯酯的物质的量为0.1mol,完全燃烧后生成0.3molCO₂,在标准状况下其体积为6.72L,但题目未指明CO₂是否处于标准状况,D错误。
答案
(1)①ABCFGH ②DEIJK ③ACEFHIK ④饱和 方向
(2)A
查看更多完整答案,请扫码查看


