2025年同步练习册人民教育出版社高中化学选择性必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第12页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
6. 氟离子中电子的运动状态有(
A.3 种
B.8 种
C.10 种
D.12 种
C
)。A.3 种
B.8 种
C.10 种
D.12 种
答案:
6.C 解析氟离子核外有10个电子,所以有10种不同运动状态的电子。
7. 下列离子中 $ d $ 轨道达全充满状态的是(
A.$ Cr^{3+} $
B.$ Cu^+ $
C.$ Co^{3+} $
D.$ Fe^{3+} $
B
)。A.$ Cr^{3+} $
B.$ Cu^+ $
C.$ Co^{3+} $
D.$ Fe^{3+} $
答案:
7.B 解析$Cr^{3+}$的核外电子排布式为$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{3},$d轨道不是全充满状态,A项不符合题意$;Cu^{+}$的核外电子排布式为$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{10},$d轨道处于全满状态,B项符合题意$;Co^{3+}$的核外电子排布式为$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{6},$d轨道不是全充满状态,C项不符合题意$;Fe^{3+}$的核外电子排布式为$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{5},$d轨道处于半充满状态,D项不符合题意。
8. 已知锰的核电荷数为 25,以下是一些同学绘制的基态锰原子的轨道表示式,其中最能准确表示基态锰原子核外电子运动状态的是( )。


答案:
8.D解析基态Mn原子的核外电子排布式为$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{5}4s^{2},$其中3d轨道上排布了5个电子,为半充满状态,各电子分占不同的轨道,且自旋平行。A项中,3d轨道上电子排布违反了洪特规则,错误;B项中,s轨道上两个电子应自旋相反,错误;C项中3d轨道上电子排布违反了洪特规则,错误。
1. 图 1 和图 2 分别是 $ 1s $ 电子的概率密度分布图和电子云轮廓图。下列有关说法正确的是(

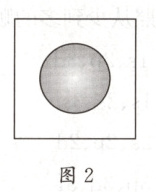
A.图 1 中的每个小点表示 1 个电子
B.图 2 表示 $ 1s $ 电子只能在球体内出现
C.图 2 表明 $ 1s $ 轨道呈球形,有无数对称轴
D.图 1 中的小点表示电子在核外所处的位置
C
)。

A.图 1 中的每个小点表示 1 个电子
B.图 2 表示 $ 1s $ 电子只能在球体内出现
C.图 2 表明 $ 1s $ 轨道呈球形,有无数对称轴
D.图 1 中的小点表示电子在核外所处的位置
答案:
1.C 解析小点是1s电子在原子核外出现的概率密度的形象描述,A、D项错误;图2表示1s电子在球体内出现的概率大于90%,在球体外出现的概率不足10%,B项错误。
2. (双选)下列各原子或离子的电子排布式错误的是(
A.$ Ca^{2+} $ $ 1s^22s^22p^63s^23p^6 $
B.$ O^{2-} $ $ 1s^22s^22p^4 $
C.$ Fe $ $ 1s^22s^22p^63s^23p^63d^64s^2 $
D.$ Fe^{2+} $ $ 1s^22s^22p^63s^23p^63d^44s^2 $
BD
)。A.$ Ca^{2+} $ $ 1s^22s^22p^63s^23p^6 $
B.$ O^{2-} $ $ 1s^22s^22p^4 $
C.$ Fe $ $ 1s^22s^22p^63s^23p^63d^64s^2 $
D.$ Fe^{2+} $ $ 1s^22s^22p^63s^23p^63d^44s^2 $
答案:
2.BD 解析氧原子的电子排布式为$1s^{2}2s^{2}2p^{4},$因此$O^{2-}$的电子排布式为$1s^{2}2s^{2}2p^{6},$B 项错误;原子失去电子形成离子时,应先失去最外层上的电子,Fe原子的电子排布式为$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{6}4s^{2},$由铁原子转化成$Fe^{2+}$时,应先失去4s上的电子,故$Fe^{2+}$的电子排布式为$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{6},$D项错误。
3. (双选)下列对核外电子运动状况的描述正确的是( )。
A.同一原子中,$ 2p $、$ 3p $、$ 4p $ 能级的原子轨道数相同且轨道的能量依次升高
B.当碳原子的核外电子排布由
 转变为
转变为 时,这一过程中释放能量
时,这一过程中释放能量
C.$ 3p^2 $ 表示 $ 3p $ 能级有两个轨道
D.在同一能级上运动的电子,其运动状态可能相同
A.同一原子中,$ 2p $、$ 3p $、$ 4p $ 能级的原子轨道数相同且轨道的能量依次升高
B.当碳原子的核外电子排布由
 转变为
转变为 时,这一过程中释放能量
时,这一过程中释放能量C.$ 3p^2 $ 表示 $ 3p $ 能级有两个轨道
D.在同一能级上运动的电子,其运动状态可能相同
答案:
3.AB
4. (双选)通常情况下,原子核外 $ p $ 能级、$ d $ 能级等原子轨道上电子排布为“全空”“半满”“全满”的时候更加稳定,称为洪特规则的特例。下列事实能作为这个规则证据的是( )。
A.元素氦($ He $)失去一个电子比元素氢($ H $)困难
B.${26}Fe^{2+} $ 容易失电子转变成 ${26}Fe^{3+} $,表现出较强的还原性
C.基态铜($ Cu $)原子的电子排布式为 $ [Ar]3d^{10}4s^1 $ 而不是 $ [Ar]3d^94s^2 $
D.某种激发态碳($ C $)原子排布式为 $ 1s^22s^12p^3 $ 而不是 $ 1s^22s^22p^2 $
A.元素氦($ He $)失去一个电子比元素氢($ H $)困难
B.${26}Fe^{2+} $ 容易失电子转变成 ${26}Fe^{3+} $,表现出较强的还原性
C.基态铜($ Cu $)原子的电子排布式为 $ [Ar]3d^{10}4s^1 $ 而不是 $ [Ar]3d^94s^2 $
D.某种激发态碳($ C $)原子排布式为 $ 1s^22s^12p^3 $ 而不是 $ 1s^22s^22p^2 $
答案:
4.BC 解析氦和氢元素的原子中均没有p、d 能级,故不涉及洪特规则$;^{26}Fe^{2+}$容易失电子转变成$^{26}Fe^{3+}$是由于$^{26}Fe^{2+}$的3d轨道上有6个电子,既不是全充满也不是全空,故通常容易失去一个电子变为3d轨道处于半充满状态的$^{26}Fe^{3+},$表现出较强的还原性;基态铜(Cu)原子的电子排布式为$[Ar]3d^{10}4s^{1},$而不是$[Ar]3d^{9}4s^{2},$是因为前者3d轨道全充满,后者3d轨道既不是全充满也不是半充满;某种激发态碳(C)原子排布式为$1s^{2}2s^{1}2p^{3}$而不是$1s^{2}2s^{2}2p^{2},$是因为$1s^{2}2s^{2}2p^{2}$是符合能量最低原则的基态原子。
查看更多完整答案,请扫码查看


