2025年同步练习册人民教育出版社高中化学选择性必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第92页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
[例题1]下列物质按熔、沸点由高到低顺序排列,正确的一组是(
A.F2、C12、Br2、I2
B.HI、HBr、HC1、HF
C.CI4、CBr4、CC14、CF4
D.HO、HS、HSe、HTe
C
)。A.F2、C12、Br2、I2
B.HI、HBr、HC1、HF
C.CI4、CBr4、CC14、CF4
D.HO、HS、HSe、HTe
答案:
[例题1]C 解析 对结构和组成相似的分子晶体,其熔、沸点随着相对分子质量的增大而升高,但 HF、H₂O 分子之间都存在氢键,熔、沸点反常。所以 A 项中应为 I₂>Br₂>Cl₂>F₂;B 项中应为 HF>HI>HBr>HCl;D 项中应为 H₂O>H₂Te>H₂Se>H₂S。
[变式训练1](1)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253K,沸点为376K,其固体属于_______晶体。
(2)比较下列锗(第IVA族元素)卤化物的熔点和沸点,分析锗卤化物熔、沸点变化的原因:_______。

GeCl水解可获得高纯GeO2,经H2还原成金属Ge。GeCl的空间结构为_______。
(3)Ge单晶具有金刚石型结构,Ge单
晶的熔点比金刚石_______(填“高”或“低”)。
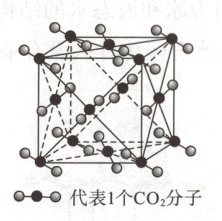
(4)下图为CO2分子晶体结构的一部
分,观察图形,试说明每个CO2分子周围有
_______个与之紧邻的CO2分子;该结构单元平均占有_______个CO2分子。
(2)比较下列锗(第IVA族元素)卤化物的熔点和沸点,分析锗卤化物熔、沸点变化的原因:_______。

GeCl水解可获得高纯GeO2,经H2还原成金属Ge。GeCl的空间结构为_______。
(3)Ge单晶具有金刚石型结构,Ge单
晶的熔点比金刚石_______(填“高”或“低”)。
(4)下图为CO2分子晶体结构的一部
分,观察图形,试说明每个CO2分子周围有
_______个与之紧邻的CO2分子;该结构单元平均占有_______个CO2分子。

答案:
[变式训练1]答案
(1)分子
(2)GeCl₄、GeBr₄、GeI₄ 均为分子晶体,随相对分子质量增大,分子间作用力增大,熔、沸点升高 正四面体
(3)低
(4)12 4
(1)分子
(2)GeCl₄、GeBr₄、GeI₄ 均为分子晶体,随相对分子质量增大,分子间作用力增大,熔、沸点升高 正四面体
(3)低
(4)12 4
1.金刚石的晶胞和晶体结构如图所示:
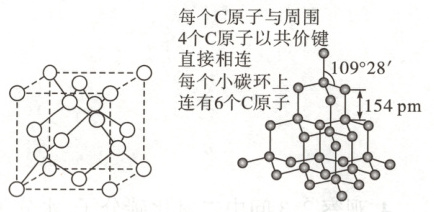
金刚石的晶胞示意图和晶体结构
(1)观察晶胞示意图中有几个碳原子。
(2)观察晶体结构中每个碳原子与几个碳原子相连。每个碳原子采取什么杂化方式?空间结构是什么?
2.下表是某些共价晶体的熔点和莫氏
硬度:
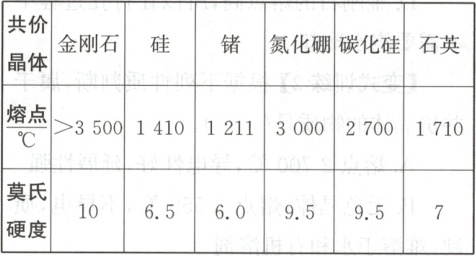
分析表中的数据,从原子结构的角度回
答下列问题:
(1)为什么金刚石、硅和锗的熔点、硬度
依次下降?
(2)为什么氮化硼、碳化硅、石英的熔
点、硬度依次下降?

金刚石的晶胞示意图和晶体结构
(1)观察晶胞示意图中有几个碳原子。
(2)观察晶体结构中每个碳原子与几个碳原子相连。每个碳原子采取什么杂化方式?空间结构是什么?
2.下表是某些共价晶体的熔点和莫氏
硬度:

分析表中的数据,从原子结构的角度回
答下列问题:
(1)为什么金刚石、硅和锗的熔点、硬度
依次下降?
(2)为什么氮化硼、碳化硅、石英的熔
点、硬度依次下降?
答案:
[探究任务2]问题引领 1.
(1)提示 8
(2)提示 4;sp³;正四面体。
2.
(1)提示 金刚石、硅和锗为同主族元素组成的单质,且均为共价晶体,因原子半径依次增大,键长依次增大,键能依次减小,故对应共价晶体的熔点、硬度依次下降。
(2)提示 共价晶体的熔点、硬度等物理性质取决于晶体内的共价键,构成共价晶体的原子半径越小,键长越短,键能越大,对应共价晶体的熔点越高,硬度越大。
(1)提示 8
(2)提示 4;sp³;正四面体。
2.
(1)提示 金刚石、硅和锗为同主族元素组成的单质,且均为共价晶体,因原子半径依次增大,键长依次增大,键能依次减小,故对应共价晶体的熔点、硬度依次下降。
(2)提示 共价晶体的熔点、硬度等物理性质取决于晶体内的共价键,构成共价晶体的原子半径越小,键长越短,键能越大,对应共价晶体的熔点越高,硬度越大。
查看更多完整答案,请扫码查看


