2025年同步练习册人民教育出版社高中化学选择性必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第13页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
5. (1) $ Fe^{2+} $ 与 $ Fe^{3+} $ 中未成对的电子数之比为
(2) 钙钛矿($ CaTiO_3 $)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,基态 $ Ti $ 原子的核外电子排布式为
(3) 基态 $ Sn $ 原子价层电子的空间运动状态有
4:5
。(2) 钙钛矿($ CaTiO_3 $)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,基态 $ Ti $ 原子的核外电子排布式为
1s^22s^22p^63s^23p^63d^24s^2 或 [Ar]3d^24s^2
。(3) 基态 $ Sn $ 原子价层电子的空间运动状态有
3
种,基态氧原子的价层电子排布式不能表示为 $ 2s^22p_x^22p_y^2 $,因为这违背了洪特
原理(规则)。
答案:
5.解析
(1)基态铁原子的价层电子排布式为$3d^{6}4s^{2},$失去电子转化为$Fe^{2+}$和$Fe^{3+},$这两种离子的价层电子排布式分别为$3d^{6}$和$3d^{5},$根据洪特规则可知,$Fe^{2+}$有4个未成对电子,$Fe^{3+}$有5个未成对电子,所以未成对电子个数比为4:5。
(2)钛元素是22号元素,故其基态原子的核外电子排布式为$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{2}4s^{2}$或$[Ar]3d^{2}4s^{2}。$
(3)Sn元素与C元素为同主族元素,位于第五周期,所以其价层电子排布式为$5s^{2}5p^{2},$5s能级的s轨道为一种空间运动状态,5p能级占据两个p轨道有两种空间运动状态,共有3种空间运动状态;根据洪特规则,同一能级电子要优先以自旋相同的方式分别占据不同的轨道,所以该排布式违反了洪特规则。
答案$(1)4:5 (2)1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{2}4s^{2}$或$[Ar]3d^{2}4s^{2} (3)3 $洪特
(1)基态铁原子的价层电子排布式为$3d^{6}4s^{2},$失去电子转化为$Fe^{2+}$和$Fe^{3+},$这两种离子的价层电子排布式分别为$3d^{6}$和$3d^{5},$根据洪特规则可知,$Fe^{2+}$有4个未成对电子,$Fe^{3+}$有5个未成对电子,所以未成对电子个数比为4:5。
(2)钛元素是22号元素,故其基态原子的核外电子排布式为$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{2}4s^{2}$或$[Ar]3d^{2}4s^{2}。$
(3)Sn元素与C元素为同主族元素,位于第五周期,所以其价层电子排布式为$5s^{2}5p^{2},$5s能级的s轨道为一种空间运动状态,5p能级占据两个p轨道有两种空间运动状态,共有3种空间运动状态;根据洪特规则,同一能级电子要优先以自旋相同的方式分别占据不同的轨道,所以该排布式违反了洪特规则。
答案$(1)4:5 (2)1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{2}4s^{2}$或$[Ar]3d^{2}4s^{2} (3)3 $洪特
原子结构与元素周期表
1. 元素周期律、元素周期系和元素周期表
(1) 元素周期律的含义:元素的性质随_________递增而呈周期性的变化。
(2) 元素周期系:元素按其_________递增排列的序列称为元素周期系。
(3) 元素周期系与元素周期表的关系:
① 元素周期表是呈现元素周期系的_________。
② 元素周期系只有一个,元素周期表_________。
(4) 三张有重要历史意义的周期表:
①_______年,门捷列夫制作了历史上第一张周期表,又称_________;
②_______年,配位化学鼻祖维尔纳制作了一张周期表,是特长式周期表;
③_______年,玻尔获诺贝尔奖时做了题为“原子结构”的报告,用原子结构解释周期系制作了一张周期表,称为_________。
2. 构造原理与元素周期表
(1) 构造原理与元素周期表的关系。
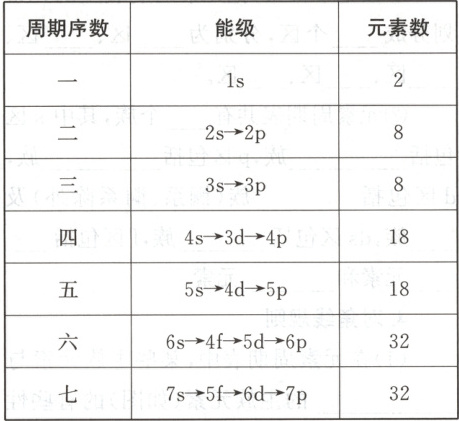
(2) 构造原理的应用:根据构造原理得出的核外电子排布,可以解释元素周期系的基本结构。例如,解释元素周期系中每个周期的元素数,除第一周期外,其余各周期总是从ns能级开始,以np能级结束,而从ns能级开始以np能级结束递增的核电荷数(或电子数)就等于每个周期里的元素数。
3. 元素周期表的结构

(3) 元素的分区:
① 按电子排布,把元素周期表里的元素划分成_________个区,分别为_________区、_______区、_______区、_______区、_______区。
② 元素周期表共有_________个族,其中s区包括_________族,p区包括_________族,d区包括_________族(镧系、锕系除外)及_________族,ds区包括_________族,f区包括_________元素和_________元素。
4. 对角线规则
(1) 在元素周期表中,某些主族元素与_________的主族元素(如图)的有些性质是相似的,这种相似性被称为对角线规则。如Li与_________、Be与_________、B与_________的某些性质分别相似。

(2) 对角线规则是从相关元素及其化合物的许多性质中_________出来的_________,如Li和Mg在过量的O₂中燃烧分别生成Li₂O和MgO,而不是过氧化物。
1. 元素周期律、元素周期系和元素周期表
(1) 元素周期律的含义:元素的性质随_________递增而呈周期性的变化。
(2) 元素周期系:元素按其_________递增排列的序列称为元素周期系。
(3) 元素周期系与元素周期表的关系:
① 元素周期表是呈现元素周期系的_________。
② 元素周期系只有一个,元素周期表_________。
(4) 三张有重要历史意义的周期表:
①_______年,门捷列夫制作了历史上第一张周期表,又称_________;
②_______年,配位化学鼻祖维尔纳制作了一张周期表,是特长式周期表;
③_______年,玻尔获诺贝尔奖时做了题为“原子结构”的报告,用原子结构解释周期系制作了一张周期表,称为_________。
2. 构造原理与元素周期表
(1) 构造原理与元素周期表的关系。

(2) 构造原理的应用:根据构造原理得出的核外电子排布,可以解释元素周期系的基本结构。例如,解释元素周期系中每个周期的元素数,除第一周期外,其余各周期总是从ns能级开始,以np能级结束,而从ns能级开始以np能级结束递增的核电荷数(或电子数)就等于每个周期里的元素数。
3. 元素周期表的结构

(3) 元素的分区:
① 按电子排布,把元素周期表里的元素划分成_________个区,分别为_________区、_______区、_______区、_______区、_______区。
② 元素周期表共有_________个族,其中s区包括_________族,p区包括_________族,d区包括_________族(镧系、锕系除外)及_________族,ds区包括_________族,f区包括_________元素和_________元素。
4. 对角线规则
(1) 在元素周期表中,某些主族元素与_________的主族元素(如图)的有些性质是相似的,这种相似性被称为对角线规则。如Li与_________、Be与_________、B与_________的某些性质分别相似。

(2) 对角线规则是从相关元素及其化合物的许多性质中_________出来的_________,如Li和Mg在过量的O₂中燃烧分别生成Li₂O和MgO,而不是过氧化物。
答案:
1.
(1)原子序数
(2)原子序数(即原子核电荷数)
(3)①表格 ②多种多样
(4)①1869 短式周期表 ②1905 ③1922 玻尔元素周期表3.
(1)短 2 8 8 长 18 18 32 32
(2)ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA;ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ
(3)①5 s p d f ds ②16 ⅠA、ⅡA ⅢA~ⅦA、0 ⅢB~ⅦB Ⅷ ⅠB、ⅡB 镧系 锕系4.
(1)右下方 Mg Al Si
(2)总结 经验规则
(1)原子序数
(2)原子序数(即原子核电荷数)
(3)①表格 ②多种多样
(4)①1869 短式周期表 ②1905 ③1922 玻尔元素周期表3.
(1)短 2 8 8 长 18 18 32 32
(2)ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA;ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ
(3)①5 s p d f ds ②16 ⅠA、ⅡA ⅢA~ⅦA、0 ⅢB~ⅦB Ⅷ ⅠB、ⅡB 镧系 锕系4.
(1)右下方 Mg Al Si
(2)总结 经验规则
自主思考2
某元素的原子序数为26,试问:
(1) 此元素原子的电子总数是多少?
(2) 它有多少个电子层?有多少个能级?
(3) 它的价层电子是怎样排布的?它的价层电子数是多少?
(4) 它位于第几周期?第几族?属于主族元素还是副族元素?属于哪个区?
(5) 它有多少个未成对电子?
某元素的原子序数为26,试问:
(1) 此元素原子的电子总数是多少?
(2) 它有多少个电子层?有多少个能级?
(3) 它的价层电子是怎样排布的?它的价层电子数是多少?
(4) 它位于第几周期?第几族?属于主族元素还是副族元素?属于哪个区?
(5) 它有多少个未成对电子?
答案:
[自主思考2]提示
(1)电子总数为26。
(2)4个电子层;7个能级。
(3)价层电子排布为3d⁶4s²;价层电子数为8。
(4)第四周期;第Ⅷ族;属于副族元素;属于d区。
(5)有4个未成对电子。
(1)电子总数为26。
(2)4个电子层;7个能级。
(3)价层电子排布为3d⁶4s²;价层电子数为8。
(4)第四周期;第Ⅷ族;属于副族元素;属于d区。
(5)有4个未成对电子。
效果自测
1. 判断正误,正确的画“√”,错误的画“×”。
(1) 元素原子的价层电子不一定是最外层电子。( )
(2) 周期表中第ⅢB族到第ⅡB族为过渡元素,全部为金属元素。( )
(3) s区元素都是金属元素,p区元素都是非金属元素。( )
(4) 价层电子数与最高正价相等的元素一定是主族元素。( )
(5) 当某元素的$\frac{能层数}{最外层电子数}\geq1$时,该元素是金属元素。( )
1. 判断正误,正确的画“√”,错误的画“×”。
(1) 元素原子的价层电子不一定是最外层电子。( )
(2) 周期表中第ⅢB族到第ⅡB族为过渡元素,全部为金属元素。( )
(3) s区元素都是金属元素,p区元素都是非金属元素。( )
(4) 价层电子数与最高正价相等的元素一定是主族元素。( )
(5) 当某元素的$\frac{能层数}{最外层电子数}\geq1$时,该元素是金属元素。( )
答案:
1.答案
(1)√
(2)√
(3)×
(4)×
(5)×
(1)√
(2)√
(3)×
(4)×
(5)×
查看更多完整答案,请扫码查看


