2025年同步练习册人民教育出版社高中化学选择性必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第21页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
一、原子半径
1.影响原子半径大小的因素
 2.原子半径大小的变化规律
2.原子半径大小的变化规律
(1)同周期主族元素,从左到右原子半径
(2)同主族元素,从上到下原子半径
1.影响原子半径大小的因素
 2.原子半径大小的变化规律
2.原子半径大小的变化规律(1)同周期主族元素,从左到右原子半径
逐渐减小
。(2)同主族元素,从上到下原子半径
逐渐增大
。
答案:
(1)逐渐减小
(2)逐渐增大
(1)逐渐减小
(2)逐渐增大
二、电离能
1.第一电离能
(1)定义:
(2)单位与符号:第一电离能用符号I1 表示,单位为kJ.mol−¹。
2.第一电离能的变化规律
(1)每个周期的
(2)同族元素从上到下,元素的第一电离能
1.第一电离能
(1)定义:
气态基态
原子失去一个
电子转化为气态基态正离子所需要的最低能量
叫做第一电离能。(2)单位与符号:第一电离能用符号I1 表示,单位为kJ.mol−¹。
2.第一电离能的变化规律
(1)每个周期的
第一种
元素(氢和碱金属
)的第一电离能最小,最后
一种元素(稀有气体
)的第一电离能最大,从左到右,元素的第一电离能呈增大
的趋势。(2)同族元素从上到下,元素的第一电离能
变小
。
答案:
1.
(1)气态基态;一个;最低能量
2.
(1)第一种(氢和碱金属);最后(稀有气体);增大
(2)变小
(1)气态基态;一个;最低能量
2.
(1)第一种(氢和碱金属);最后(稀有气体);增大
(2)变小
三、电负性
1.化学键与键合电子
(1)化学键:元素相互化合,可以理解为
_______之间产生_________作用力,形象地
叫做化学键。
(2)键合电子:原子中用于形成_________
_______的电子称为键合电子。
2.电负性
(1)定义:用来描述不同元素的原子对
_______吸引力的大小。电负性越大
的原子,对_________的吸引力_________。
(2)衡量标准:以氟的电负性为4.0和
锂的电负性为1.0作为相对标准。
(3)递变规律。
①一般来说,同周期元素从左到右,元
素的电负性逐渐_________。
②一般来说,同族元素从上到下,元素
的电负性逐渐_________。
(4)应用:判断元素金属性和非金属性
的强弱。
①金属元素的电负性一般小于1.8。
②非金属元素的电负性一般大于1.8。
③位于非金属三角区边界的“类金属”
(如锗、锑等)的电负性在1.8左右的,它们
既有_________,又有_________。
1.化学键与键合电子
(1)化学键:元素相互化合,可以理解为
_______之间产生_________作用力,形象地
叫做化学键。
(2)键合电子:原子中用于形成_________
_______的电子称为键合电子。
2.电负性
(1)定义:用来描述不同元素的原子对
_______吸引力的大小。电负性越大
的原子,对_________的吸引力_________。
(2)衡量标准:以氟的电负性为4.0和
锂的电负性为1.0作为相对标准。
(3)递变规律。
①一般来说,同周期元素从左到右,元
素的电负性逐渐_________。
②一般来说,同族元素从上到下,元素
的电负性逐渐_________。
(4)应用:判断元素金属性和非金属性
的强弱。
①金属元素的电负性一般小于1.8。
②非金属元素的电负性一般大于1.8。
③位于非金属三角区边界的“类金属”
(如锗、锑等)的电负性在1.8左右的,它们
既有_________,又有_________。
答案:
1.
(1)原子;化学
(2)化学键2.
(1)键合电子;键合电子;越大
(3)①变大 ②变小
(4)③金属性;非金属性
(1)原子;化学
(2)化学键2.
(1)键合电子;键合电子;越大
(3)①变大 ②变小
(4)③金属性;非金属性
[自主思考1]为什么同周期主族元素
原子半径从左到右依次减小?为什么同主
族元素原子半径从上到下依次增大?
原子半径从左到右依次减小?为什么同主
族元素原子半径从上到下依次增大?
答案:
[自主思考1]提示由于同周期主族元素原子随着核电荷数的增加,原子核对电子的吸引作用增大,而使原子半径减小的趋势大于增加电子后电子间排斥作用增大带来原子半径增大的趋势。同主族元素从上到下,原子半径逐渐增大,其主要原因是由于电子的能层数增加,电子间的排斥作用使原子半径增大。
1.判断正误,正确的画“√”,错误的画“×”。
(1)质子数相同的不同单核粒子,电子数越多半径越大。 (
(2)铝的第一电离能比镁的第一电离能大。 (
(3)短周期内钠元素的第一电离能最小。 (
(4)同周期元素从左到右第一电离能有增大的趋势,故第一电离能C<N<O。
( )
(5)电子排布为1s22s²2p6的元素,电负性最大。 (
(6)一般认为元素的电负性小于1.8的为金属元素,大于1.8的为非金属元素。
( )
(7)金属元素的电负性通常较小,非金属元素的电负性通常较大。 ( )
(1)质子数相同的不同单核粒子,电子数越多半径越大。 (
(2)铝的第一电离能比镁的第一电离能大。 (
(3)短周期内钠元素的第一电离能最小。 (
(4)同周期元素从左到右第一电离能有增大的趋势,故第一电离能C<N<O。
( )
(5)电子排布为1s22s²2p6的元素,电负性最大。 (
(6)一般认为元素的电负性小于1.8的为金属元素,大于1.8的为非金属元素。
( )
(7)金属元素的电负性通常较小,非金属元素的电负性通常较大。 ( )
答案:
1.答案
(1)√
(2)×
(3)√
(4)×
(5)×
(6)√
(7)√
(1)√
(2)×
(3)√
(4)×
(5)×
(6)√
(7)√
2.如图是第三周期主族元素的某些性质随原子序数变化的柱形图,则纵轴可表示( )。
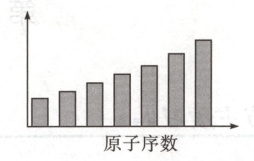
①第一电离能 ②电负性 ③原子半
径 ④简单离子半径 5最高正化合价
⑥形成简单离子转移的电子数
A.①③④⑥
B.①②③⑤
C.②④⑤
D.②⑤

①第一电离能 ②电负性 ③原子半
径 ④简单离子半径 5最高正化合价
⑥形成简单离子转移的电子数
A.①③④⑥
B.①②③⑤
C.②④⑤
D.②⑤
答案:
2.D
查看更多完整答案,请扫码查看


