2025年同步练习册人民教育出版社高中化学选择性必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第23页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
[例题1]四种元素的基态原子的电子排
布式如下:①1s²2s²2p63s²3p⁴ ②1s²2s²²2p⁶3s²3p)³
③1s²2s²2p² ④1s²2s²2p²,则四种原子的
半径按由大到小的顺序排列正确的是
(
A.①>②>③>④
B.②>①>③>④
C.②>①>④>③
D.①>②>④>③
布式如下:①1s²2s²2p63s²3p⁴ ②1s²2s²²2p⁶3s²3p)³
③1s²2s²2p² ④1s²2s²2p²,则四种原子的
半径按由大到小的顺序排列正确的是
(
B
)。A.①>②>③>④
B.②>①>③>④
C.②>①>④>③
D.①>②>④>③
答案:
B
[变式训练1]下列各组粒子半径的比
较正确的是(
①C1<C1−
A1²+ ③Ca²+<Ca<Ba ④S²−<Se²−<
Br−
A.①和③
B.①和②
C.③和④
D.①和④
较正确的是(
A
)。①C1<C1−
A1²+ ③Ca²+<Ca<Ba ④S²−<Se²−<
Br−
A.①和③
B.①和②
C.③和④
D.①和④
答案:
A
1.下表是第二、第三周期元素的第一电离能数据:
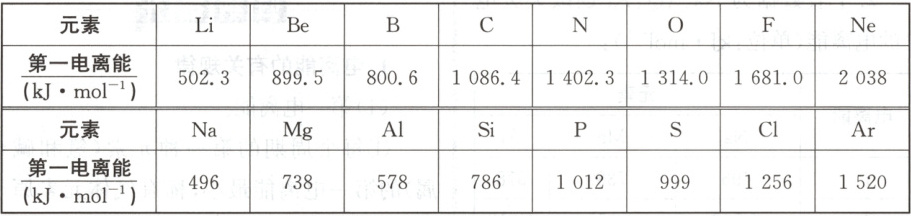
(1)将上表数据,以原子序数为横坐标,以第一电离能为纵坐标画图。
(2)讨论 Li~Ne 和 Na~Ar 第一电离能变化的总趋势。
(3)试从两个不同的视角解释表中 B 与 Al、O 与 S 两处的反常现象。
2.下表数据为Na、Mg、A1逐级失去电
子的电离能(单位:kJ.mol−1):
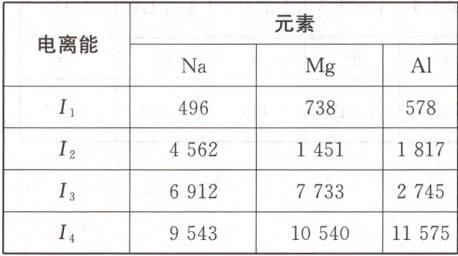
分析上表中各元素原子的逐级电离能
的变化,回答下列问题。
(1)为什么同一元素的电离能逐级
增大?
(2)为什么Na、Mg、A1的化合价分别
为+1、+2、+3价?

(1)将上表数据,以原子序数为横坐标,以第一电离能为纵坐标画图。
(2)讨论 Li~Ne 和 Na~Ar 第一电离能变化的总趋势。
(3)试从两个不同的视角解释表中 B 与 Al、O 与 S 两处的反常现象。
2.下表数据为Na、Mg、A1逐级失去电
子的电离能(单位:kJ.mol−1):

分析上表中各元素原子的逐级电离能
的变化,回答下列问题。
(1)为什么同一元素的电离能逐级
增大?
(2)为什么Na、Mg、A1的化合价分别
为+1、+2、+3价?
答案:
1.
(1)
(2)Li~Ne和Na~Ar的第一电离能变化总体呈增大的趋势。
(3)角度一 从洪特规则特例方面:电离能大小反常的是B与Al、O与S。Be、Mg的2s、3s能级分别有2个电子,为全充满的稳定结构,所以第一电离能是Be比B大,Mg比Al大。N、P的2p、3p能级分别有3个电子,为半充满的较稳定结构,所以第一电离能是N比O大,P比S大。
角度二 能量的高低方面:B与Al的第一电离能失去的电子是np能级的,该能级电子的能量比左边Be与Mg失去的ns能级电子的能量高。
2.
(1)同一元素的逐级电离能是逐渐增大的,即I₁<I₂<I₃<……,这是由于原子失去一个电子变成+1价阳离子后,半径变小,核电荷数未变而电子数目变少,原子核对电子的吸引作用增强,因而第二个电子比第一个电子难失去,失去第二个电子比失去第一个电子需要更多的能量。同理,I₃>I₂,I₄>I₃……Iₙ₊₁>Iₙ。
(2)Na的I₁比I₂小很多,电离能差值很大,说明失去第一个电子比失去第二个电子容易得多,所以Na容易失去一个电子形成+1价离子;Mg的I₁和I₂相差不多,而I₂比I₃小很多,所以Mg容易失去两个电子形成+2价离子;Al的I₁、I₂、I₃相差不多,而I₃比I₄小很多,所以Al容易失去三个电子形成+3价离子。
1.
(1)

(2)Li~Ne和Na~Ar的第一电离能变化总体呈增大的趋势。
(3)角度一 从洪特规则特例方面:电离能大小反常的是B与Al、O与S。Be、Mg的2s、3s能级分别有2个电子,为全充满的稳定结构,所以第一电离能是Be比B大,Mg比Al大。N、P的2p、3p能级分别有3个电子,为半充满的较稳定结构,所以第一电离能是N比O大,P比S大。
角度二 能量的高低方面:B与Al的第一电离能失去的电子是np能级的,该能级电子的能量比左边Be与Mg失去的ns能级电子的能量高。
2.
(1)同一元素的逐级电离能是逐渐增大的,即I₁<I₂<I₃<……,这是由于原子失去一个电子变成+1价阳离子后,半径变小,核电荷数未变而电子数目变少,原子核对电子的吸引作用增强,因而第二个电子比第一个电子难失去,失去第二个电子比失去第一个电子需要更多的能量。同理,I₃>I₂,I₄>I₃……Iₙ₊₁>Iₙ。
(2)Na的I₁比I₂小很多,电离能差值很大,说明失去第一个电子比失去第二个电子容易得多,所以Na容易失去一个电子形成+1价离子;Mg的I₁和I₂相差不多,而I₂比I₃小很多,所以Mg容易失去两个电子形成+2价离子;Al的I₁、I₂、I₃相差不多,而I₃比I₄小很多,所以Al容易失去三个电子形成+3价离子。
查看更多完整答案,请扫码查看


