2025年人教金学典同步解析与测评高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年人教金学典同步解析与测评高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第62页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
2. (2022·全国甲节选)金属钛(${Ti}$)在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石(${TiO_{2}}$)转化为${TiCl_{4}}$,再进一步还原得到钛。回答下列问题。
(1)${TiO_{2}}$转化为${TiCl_{4}}$有直接氯化法和碳氯化法。在$1000\ ^{\circ}C$时反应的热化学方程式及其平衡常数如下。
(ⅰ)直接氯化:${TiO_{2}(s) + 2Cl_{2}(g) = TiCl_{4}(g) + O_{2}(g)}$ $\Delta H_{1} = +172\ kJ/mol$,$K_{p_{1}} = 1.0 × 10^{-2}$
(ⅱ)碳氯化:${TiO_{2}(s) + 2Cl_{2}(g) + 2C(s) = TiCl_{4}(g) + 2CO(g)}$ $\Delta H_{2} = -51\ kJ/mol$,$K_{p_{2}} = 1.2 × 10^{12}\ Pa$
①碳氯化的反应趋势远大于直接氯化,其原因是________。
②对于碳氯化反应:增大压强,平衡________(填“向左”“向右”或“不”)移动;温度升高,平衡转化率________(填“变大”“变小”或“不变”)。
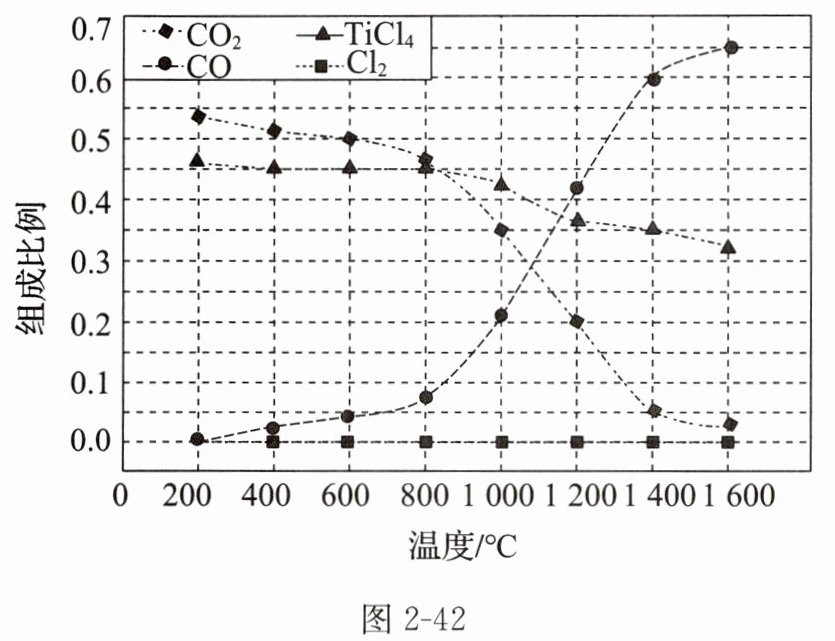
(2)在$1.0 × 10^{5}\ Pa$时,将${TiO_{2}}$、${C}$、${Cl_{2}}$以物质的量比$1:2.2:2$进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图2-42所示。
①反应${C(s) + CO_{2}(g) = 2CO(g)}$的平衡常数$K_{p}(1400\ ^{\circ}C) = $_________$\ Pa$。
②图中显示,在$200\ ^{\circ}C$平衡时${TiO_{2}}$几乎完全转化为${TiCl_{4}}$,但实际生产中反应温度却远高于此温度,其原因是________。
(3)${TiO_{2}}$碳氯化是一个“气-固-固”反应,有利于${TiO_{2}-C}$“固-固”接触的措施是________。
【解析】(1)①碳氯化的反应,既是熵增反应又是放热反应,有利于反应正向进行,直接氯化的反应是吸热反应,不利于反应正向进行,所以碳氯化的反应趋势远大于直接氯化。
②根据勒夏特列原理可知,增大压强,平衡向气体分子数减小的方向移动,${TiO_{2}(s) + 2Cl_{2}(g) + 2C(s) = TiCl_{4}(g) + 2CO(g)}$ $\Delta H_{2} = -51\ kJ/mol$,生成物气体的分子数大于反应物气体的分子数,故平衡向左移动;该反应是放热反应,温度升高,平衡逆向移动,转化率变小。
(2)①由图知$1400\ ^{\circ}C$时,体系中${CO_{2}}$的物质的量分数是$0.05$,${CO}$的物质的量分数是$0.6$,$K_{p}(1400\ ^{\circ}C) = \dfrac{p^{2}({CO})}{p({CO_{2}})} = \dfrac{(1.0 × 10^{5} × 0.6)^{2}}{1.0 × 10^{5} × 0.05} = 7.2 × 10^{5}$。
②考虑实际生产中要尽可能地在单位时间内多出产品,故实际反应温度远高于$200\ ^{\circ}C$是为了加快反应速率,提高生产效率。
(3)将固体粉碎有利于增大接触面积。
(1)${TiO_{2}}$转化为${TiCl_{4}}$有直接氯化法和碳氯化法。在$1000\ ^{\circ}C$时反应的热化学方程式及其平衡常数如下。
(ⅰ)直接氯化:${TiO_{2}(s) + 2Cl_{2}(g) = TiCl_{4}(g) + O_{2}(g)}$ $\Delta H_{1} = +172\ kJ/mol$,$K_{p_{1}} = 1.0 × 10^{-2}$
(ⅱ)碳氯化:${TiO_{2}(s) + 2Cl_{2}(g) + 2C(s) = TiCl_{4}(g) + 2CO(g)}$ $\Delta H_{2} = -51\ kJ/mol$,$K_{p_{2}} = 1.2 × 10^{12}\ Pa$
①碳氯化的反应趋势远大于直接氯化,其原因是________。
②对于碳氯化反应:增大压强,平衡________(填“向左”“向右”或“不”)移动;温度升高,平衡转化率________(填“变大”“变小”或“不变”)。
(2)在$1.0 × 10^{5}\ Pa$时,将${TiO_{2}}$、${C}$、${Cl_{2}}$以物质的量比$1:2.2:2$进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图2-42所示。
①反应${C(s) + CO_{2}(g) = 2CO(g)}$的平衡常数$K_{p}(1400\ ^{\circ}C) = $_________$\ Pa$。
②图中显示,在$200\ ^{\circ}C$平衡时${TiO_{2}}$几乎完全转化为${TiCl_{4}}$,但实际生产中反应温度却远高于此温度,其原因是________。
(3)${TiO_{2}}$碳氯化是一个“气-固-固”反应,有利于${TiO_{2}-C}$“固-固”接触的措施是________。
【解析】(1)①碳氯化的反应,既是熵增反应又是放热反应,有利于反应正向进行,直接氯化的反应是吸热反应,不利于反应正向进行,所以碳氯化的反应趋势远大于直接氯化。
②根据勒夏特列原理可知,增大压强,平衡向气体分子数减小的方向移动,${TiO_{2}(s) + 2Cl_{2}(g) + 2C(s) = TiCl_{4}(g) + 2CO(g)}$ $\Delta H_{2} = -51\ kJ/mol$,生成物气体的分子数大于反应物气体的分子数,故平衡向左移动;该反应是放热反应,温度升高,平衡逆向移动,转化率变小。
(2)①由图知$1400\ ^{\circ}C$时,体系中${CO_{2}}$的物质的量分数是$0.05$,${CO}$的物质的量分数是$0.6$,$K_{p}(1400\ ^{\circ}C) = \dfrac{p^{2}({CO})}{p({CO_{2}})} = \dfrac{(1.0 × 10^{5} × 0.6)^{2}}{1.0 × 10^{5} × 0.05} = 7.2 × 10^{5}$。
②考虑实际生产中要尽可能地在单位时间内多出产品,故实际反应温度远高于$200\ ^{\circ}C$是为了加快反应速率,提高生产效率。
(3)将固体粉碎有利于增大接触面积。
答案:
【答案】(1)①碳氯化是熵增、放热反应,有利于反应正向进行,而直接氯化的反应是吸热反应,不利于反应正向进行 ②向左 变小
(2)①$7.2 × 10^{5}$ ②加快反应速率,提高生产效率
(3)将固体粉碎后混匀

查看更多完整答案,请扫码查看


