2025年人教金学典同步解析与测评高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年人教金学典同步解析与测评高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第45页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
12. 已知反应$A(g) + xB(g)\rightleftharpoons 2C(g)$,在密闭容器中充入等物质的量的气体$A$和$B$,达到平衡后,只改变一个反应条件,测得容器内有关物质的浓度,正、逆反应速率随时间的变化关系分别如图2-22Ⅰ、图2-22Ⅱ所示。
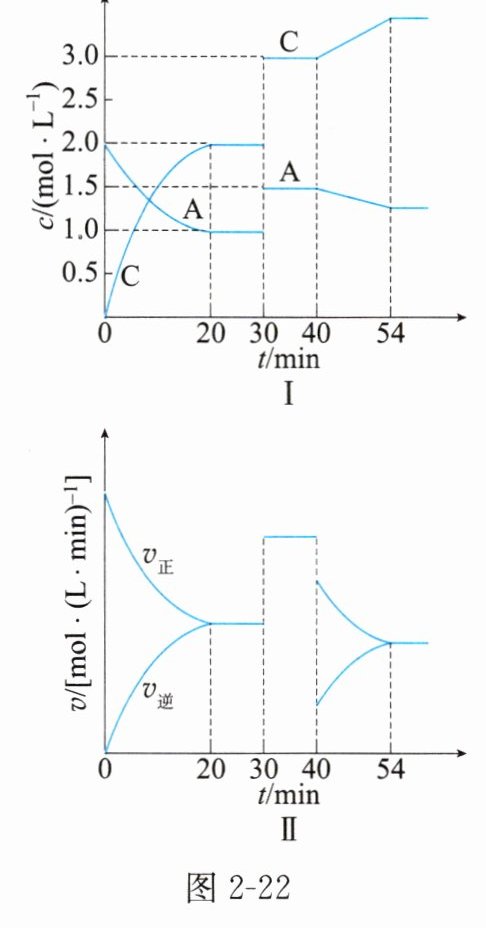
请回答下列问题。
(1) $x=$______。0~20min内$v(B)=$________。当反应达到平衡状态时,$v_{正}(B):v_{逆}(C)=$________。
(2) 在20~30min内,该反应的平衡常数$K=$________。若20min、35min、55min时,平衡常数分别为$K_{1}$、$K_{2}$、$K_{3}$,则三者大小关系为________。
(3) 当反应生成2mol C时,________(填“放出”或“吸收”)$akJ$的热量,写出该反应的热化学方程式:________________。

请回答下列问题。
(1) $x=$______。0~20min内$v(B)=$________。当反应达到平衡状态时,$v_{正}(B):v_{逆}(C)=$________。
(2) 在20~30min内,该反应的平衡常数$K=$________。若20min、35min、55min时,平衡常数分别为$K_{1}$、$K_{2}$、$K_{3}$,则三者大小关系为________。
(3) 当反应生成2mol C时,________(填“放出”或“吸收”)$akJ$的热量,写出该反应的热化学方程式:________________。
答案:
12
(1)1 $0.05\mathrm{mol/(L· min)}$ $1:2$
(2)$4.0$ $K_1=K_2<K_3$
(3)放出 $\mathrm{A(g)+B(g)\rightleftharpoons 2C(g)}$ $\Delta H=-a\mathrm{kJ/mol}$
(1)1 $0.05\mathrm{mol/(L· min)}$ $1:2$
(2)$4.0$ $K_1=K_2<K_3$
(3)放出 $\mathrm{A(g)+B(g)\rightleftharpoons 2C(g)}$ $\Delta H=-a\mathrm{kJ/mol}$
13. 在容积为1L的容器中,通入一定量的$N_{2}O_{4}$,发生反应$N_{2}O_{4}(g)\rightleftharpoons 2NO_{2}(g)$,随着温度升高,混合气体的颜色变深。
回答下列问题。
(1) 该反应的$\Delta H$________(填“$>$”或“$<$”)0。$100^{\circ}C$时,体系中各物质的浓度随时间变化如图2-23所示。在0~60s,$v(N_{2}O_{4})$为________$mol/(L·s)$,反应的平衡常数$K_{1}=$________。
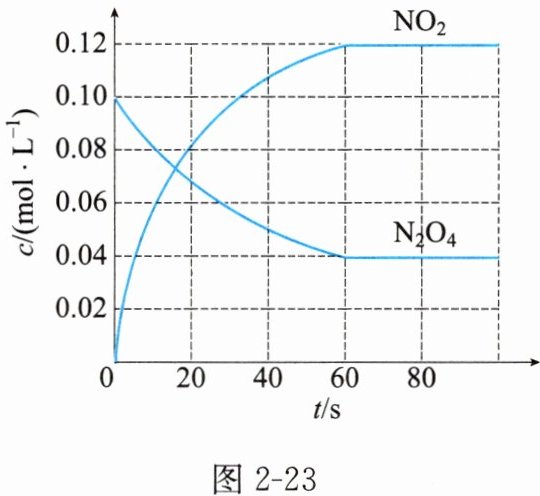
(2) $100^{\circ}C$时达到平衡后,改变反应温度为$T$,$c(N_{2}O_{4})$以$0.002mol/(L·s)$的平均速率减小,经10s又达到平衡。
①$T$________(填“$>$”或“$<$”)$100^{\circ}C$,判断理由是________________。
②温度为$T$时,反应的平衡常数$K_{2}=$________。
(3) 温度为$T$时,反应达到平衡后,将反应容器的容积减小一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是______________________________。
回答下列问题。
(1) 该反应的$\Delta H$________(填“$>$”或“$<$”)0。$100^{\circ}C$时,体系中各物质的浓度随时间变化如图2-23所示。在0~60s,$v(N_{2}O_{4})$为________$mol/(L·s)$,反应的平衡常数$K_{1}=$________。

(2) $100^{\circ}C$时达到平衡后,改变反应温度为$T$,$c(N_{2}O_{4})$以$0.002mol/(L·s)$的平均速率减小,经10s又达到平衡。
①$T$________(填“$>$”或“$<$”)$100^{\circ}C$,判断理由是________________。
②温度为$T$时,反应的平衡常数$K_{2}=$________。
(3) 温度为$T$时,反应达到平衡后,将反应容器的容积减小一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是______________________________。
答案:
13
(1)> $0.001$ $0.36$
(2)①> 正反应吸热,而反应向吸热方向进行,故温度升高
②$1.28$
(3)逆反应 对于气体分子数增大的反应,增大压强,平衡向逆反应方向移动
(1)> $0.001$ $0.36$
(2)①> 正反应吸热,而反应向吸热方向进行,故温度升高
②$1.28$
(3)逆反应 对于气体分子数增大的反应,增大压强,平衡向逆反应方向移动
查看更多完整答案,请扫码查看


