2025年人教金学典同步解析与测评高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年人教金学典同步解析与测评高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第92页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
6.25C时,将amol/L氨水与bmol/L
盐酸等体积混合,下列有关推论不正确的是
( )。
A.若混合后溶液pH=7,则c(NH)=
c(C1−)
B.若b=2a,则c(C1−)>c(NH)>
c(H+)>c(OH−)
C.若a=2b,则c(NH+)>c(C1−)>
c(OH−)>c(H+)
D.若混合后溶液满足c(H+)=
c(OH−)+c(NH.H2O),则a=b
盐酸等体积混合,下列有关推论不正确的是
( )。
A.若混合后溶液pH=7,则c(NH)=
c(C1−)
B.若b=2a,则c(C1−)>c(NH)>
c(H+)>c(OH−)
C.若a=2b,则c(NH+)>c(C1−)>
c(OH−)>c(H+)
D.若混合后溶液满足c(H+)=
c(OH−)+c(NH.H2O),则a=b
答案:
B
7.25°℃时,向25mLαmol/L一元弱
酸(HA)中加入bmL0.1mol/L一元强碱
(BOH)。下列有关判断一定正确的是( )。
A.当25a=0.1b时,c(A−)>c(B+)
B.当pH<7时,c(B+)>c(A−)
C.当pH=7且b=25时,a>0.1
D.当pH>7时,c(A−)>c(OH−)
酸(HA)中加入bmL0.1mol/L一元强碱
(BOH)。下列有关判断一定正确的是( )。
A.当25a=0.1b时,c(A−)>c(B+)
B.当pH<7时,c(B+)>c(A−)
C.当pH=7且b=25时,a>0.1
D.当pH>7时,c(A−)>c(OH−)
答案:
C
8.10°C时加热NaHCO3饱和溶液,测得该溶液的pH变化如下表所示。

(1)甲同学认为,该溶液的pH升高的
原因是HCO3的水解程度增大,故碱性增
强。该反应的离子方程式是______________。
(2)乙同学类比加热Ca(HCO3)2溶液
时会出现____________现象,认为NaHCO3
溶液pH升高的原因是NaHCO受热分解,
生成了Na2CO3,并推测水解程度:Na2CO3
______(填“大于”或“小于”)NaHCO3。
(3)丙同学认为甲、乙的判断都不充
分。丙提出以下观点。
①只要在加热煮沸后的溶液中加入足量
的试剂X,若产生沉淀,则说明__________
(填“甲”或“乙")判断正确。试剂X是
________(填字母)。
A.Ba(OH)2溶液
B.BaCl2溶液
C.NaOH溶液
D.澄清石灰水
②将加热后的溶液冷却到10°℃,若溶
液的pH__________(填“高于”“低于”或
“等于”)8.3,则说明另一判断正确。

(1)甲同学认为,该溶液的pH升高的
原因是HCO3的水解程度增大,故碱性增
强。该反应的离子方程式是______________。
(2)乙同学类比加热Ca(HCO3)2溶液
时会出现____________现象,认为NaHCO3
溶液pH升高的原因是NaHCO受热分解,
生成了Na2CO3,并推测水解程度:Na2CO3
______(填“大于”或“小于”)NaHCO3。
(3)丙同学认为甲、乙的判断都不充
分。丙提出以下观点。
①只要在加热煮沸后的溶液中加入足量
的试剂X,若产生沉淀,则说明__________
(填“甲”或“乙")判断正确。试剂X是
________(填字母)。
A.Ba(OH)2溶液
B.BaCl2溶液
C.NaOH溶液
D.澄清石灰水
②将加热后的溶液冷却到10°℃,若溶
液的pH__________(填“高于”“低于”或
“等于”)8.3,则说明另一判断正确。
答案:
(1)$HCO_3^- + H_2O \rightleftharpoons H_2CO_3 + OH^-$
(2)浑浊大于
(3)①乙 B ②等于
(1)$HCO_3^- + H_2O \rightleftharpoons H_2CO_3 + OH^-$
(2)浑浊大于
(3)①乙 B ②等于
9.直接排放含SO2的烟气会形成酸雨,
危害环境。利用钠碱循环法可脱除烟气中的
SO2。在吸收液吸收SO2的过程中,pH随
n(SO−):n(HSO)的变化如下表所示。

(1)由上表判断,NaHSO3溶液呈____性,原因是____________________________。
(2)当吸收液呈中性时,下列溶液中离子浓度关系正确的是________(填字母)。
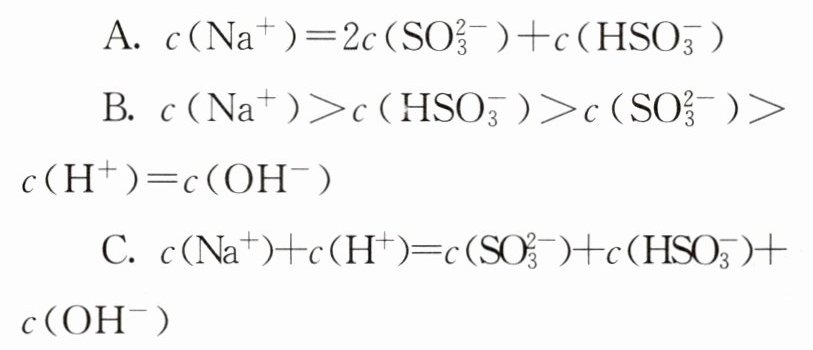
危害环境。利用钠碱循环法可脱除烟气中的
SO2。在吸收液吸收SO2的过程中,pH随
n(SO−):n(HSO)的变化如下表所示。

(1)由上表判断,NaHSO3溶液呈____性,原因是____________________________。
(2)当吸收液呈中性时,下列溶液中离子浓度关系正确的是________(填字母)。
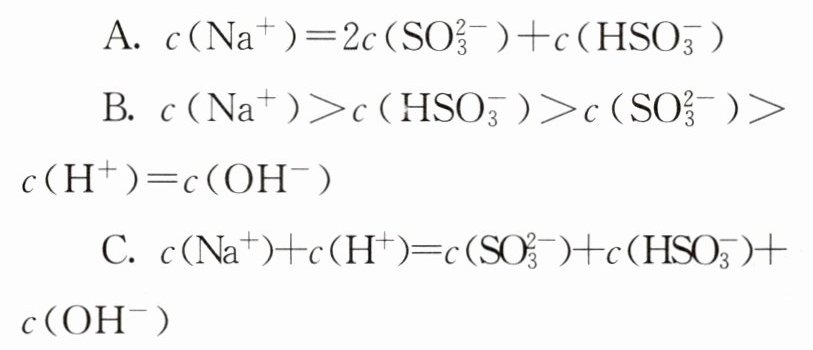
答案:
(1)酸 $HSO_3^-$存在平衡$HSO_3^- \rightleftharpoons H^+ + SO_3^{2-}$和$HSO_3^- + H_2O \rightleftharpoons H_2SO_3 + OH^-$,$HSO_3^-$的电离程度大于其水解程度
(2)AB
(1)酸 $HSO_3^-$存在平衡$HSO_3^- \rightleftharpoons H^+ + SO_3^{2-}$和$HSO_3^- + H_2O \rightleftharpoons H_2SO_3 + OH^-$,$HSO_3^-$的电离程度大于其水解程度
(2)AB
查看更多完整答案,请扫码查看


