2025年天星教育试题调研化学第9辑
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天星教育试题调研化学第9辑 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第31页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
原创预测 实验室对乙酸乙酯的制备进行可视化创新设计,实验方案如下:

①向仪器B中分别加入11.5 mL(0.2 mol)无水乙醇和6.0 mL(0.1 mol)乙酸、1.4 g NaHSO₄固体及4~6滴1‰甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。
②控制温度在75~80℃,加热回流50 min后,反应液由蓝色变为紫色,冷凝柱中变色硅胶发生变化,停止加热。
③向冷却后的仪器B中分批缓慢加入饱和Na₂CO₃溶液至无气泡产生,分离出有机相。
④依次用适量饱和食盐水、饱和CaCl₂溶液和蒸馏水洗涤有机相后,加入无水MgSO₄,过滤。
⑤蒸馏滤液,收集73~78℃馏分,得到6.60 g无色液体。
已知:①乙醇能与CaCl₂反应生成CaCl₂·6C₂H₅OH,碳酸钠微溶于乙酸乙酯。
②变色硅胶中含有少量CoCl₂。几种含钴化合物的颜色如表所示。

回答下列问题:
(1)仪器B的名称为
A. 25 mL
B. 50 mL
C. 100 mL
D. 250 mL
(2)步骤②中变色硅胶在反应中的变化为
(3)步骤③中加入饱和Na₂CO₃溶液的作用是
(4)步骤⑤中的仪器选择及安装都正确的是
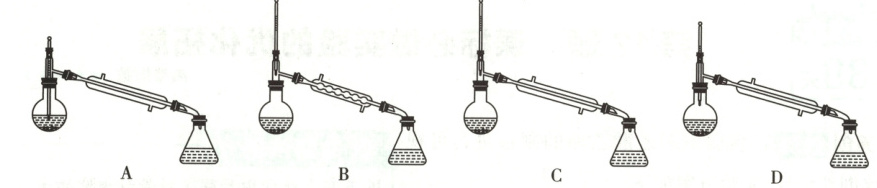
(5)下列说法错误的是
a. 步骤④中使用饱和CaCl₂溶液洗涤的目的是除去乙醇及Na₂CO₃
b. 步骤⑤中加热一段时间后发现忘记加碎瓷片,应冷却后补加
c. 步骤①中NaHSO₄固体在反应中起催化、吸水作用
d. 变色硅胶在反应中的作用除指示反应进程外,还有提高乙酸乙酯的产率
(6)经色谱检测,制得的产品纯度为96.0%,则该实验中乙酸乙酯的产率为

①向仪器B中分别加入11.5 mL(0.2 mol)无水乙醇和6.0 mL(0.1 mol)乙酸、1.4 g NaHSO₄固体及4~6滴1‰甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。
②控制温度在75~80℃,加热回流50 min后,反应液由蓝色变为紫色,冷凝柱中变色硅胶发生变化,停止加热。
③向冷却后的仪器B中分批缓慢加入饱和Na₂CO₃溶液至无气泡产生,分离出有机相。
④依次用适量饱和食盐水、饱和CaCl₂溶液和蒸馏水洗涤有机相后,加入无水MgSO₄,过滤。
⑤蒸馏滤液,收集73~78℃馏分,得到6.60 g无色液体。
已知:①乙醇能与CaCl₂反应生成CaCl₂·6C₂H₅OH,碳酸钠微溶于乙酸乙酯。
②变色硅胶中含有少量CoCl₂。几种含钴化合物的颜色如表所示。

回答下列问题:
(1)仪器B的名称为
圆底烧瓶
,所选仪器B的最佳规格是B
(填标号)。A. 25 mL
B. 50 mL
C. 100 mL
D. 250 mL
(2)步骤②中变色硅胶在反应中的变化为
由蓝色变为粉红色
。(3)步骤③中加入饱和Na₂CO₃溶液的作用是
除去乙酸和NaHSO₄
(写出一条即可),步骤④中加入无水MgSO₄的作用是干燥乙酸乙酯
。(4)步骤⑤中的仪器选择及安装都正确的是
C
(填标号)。
(5)下列说法错误的是
c
(填标号)。a. 步骤④中使用饱和CaCl₂溶液洗涤的目的是除去乙醇及Na₂CO₃
b. 步骤⑤中加热一段时间后发现忘记加碎瓷片,应冷却后补加
c. 步骤①中NaHSO₄固体在反应中起催化、吸水作用
d. 变色硅胶在反应中的作用除指示反应进程外,还有提高乙酸乙酯的产率
(6)经色谱检测,制得的产品纯度为96.0%,则该实验中乙酸乙酯的产率为
72%
。
答案:
解析
(1)仪器B为圆底烧瓶。由步骤①可知,圆底烧瓶内的液体体积为11.5 mL + 6.0 mL = 17.5 mL,圆底烧瓶中液体的体积不超过圆底烧瓶容积的2/3且不少于容积的1/3,故仪器B的最佳规格为50 mL。
(2)乙酸乙酯的制备过程中有水生成,结合已知信息②可知,步骤②中,反应前变色硅胶为蓝色,随着反应的进行,CoCl₂不断吸水,变色硅胶由蓝色变为粉红色。
(3)步骤③中加入饱和Na₂CO₃溶液的作用是中和未反应的乙酸和NaHSO₄,吸收未反应的乙醇,降低乙酸乙酯的溶解度,便于乙酸乙酯分层。无水MgSO₄能吸收水,步骤④中向有机相中加入无水MgSO₄的作用是干燥乙酸乙酯。
(4)蒸馏时,温度计液泡应位于蒸馏烧瓶的支管口处,A、D错误;蒸馏操作中冷凝管的作用是使气体冷凝为液体,为防止馏出液滞留,应选择直形冷凝管,B错误,C正确。
(5)结合已知信息①可知,CaCl₂可与未反应完的乙醇反应生成CaCl₂·6C₂H₅OH,也能与Na₂CO₃反应,故用其洗涤的目的是除去乙醇及Na₂CO₃,a正确。加热一段时间后发现忘记加碎瓷片,应冷却后补加,若直接在加热状态下加入碎瓷片,由于温差,可能会导致溶液飞溅,甚至引发安全事故,b正确。乙酸和乙醇在浓硫酸催化和加热条件下会发生酯化反应生成乙酸乙酯和水,该实验用NaHSO₄固体代替浓硫酸,起催化作用,无吸水作用,c错误。由上述分析可知,反应前变色硅胶为蓝色,反应达到终点时变为粉红色,故变色硅胶可以指示反应进程;此外变色硅胶吸水还可使酯化反应平衡正向移动,提高乙酸乙酯的产率,d正确。
(6)0.1 mol乙酸与0.2 mol乙醇反应时,由于乙醇过量,故根据乙酸的量计算乙酸乙酯的理论产量为0.1 mol×88 g·mol⁻¹ = 8.8 g,则该实验中乙酸乙酯的产率为(6.60 g×96.0%)/8.8 g×100% = 72%。
答案
(1)圆底烧瓶 B
(2)由蓝色变为粉红色
(3)除去乙酸和NaHSO₄(答案合理即可) 干燥乙酸乙酯
(4)C
(5)c
(6)72%
(1)仪器B为圆底烧瓶。由步骤①可知,圆底烧瓶内的液体体积为11.5 mL + 6.0 mL = 17.5 mL,圆底烧瓶中液体的体积不超过圆底烧瓶容积的2/3且不少于容积的1/3,故仪器B的最佳规格为50 mL。
(2)乙酸乙酯的制备过程中有水生成,结合已知信息②可知,步骤②中,反应前变色硅胶为蓝色,随着反应的进行,CoCl₂不断吸水,变色硅胶由蓝色变为粉红色。
(3)步骤③中加入饱和Na₂CO₃溶液的作用是中和未反应的乙酸和NaHSO₄,吸收未反应的乙醇,降低乙酸乙酯的溶解度,便于乙酸乙酯分层。无水MgSO₄能吸收水,步骤④中向有机相中加入无水MgSO₄的作用是干燥乙酸乙酯。
(4)蒸馏时,温度计液泡应位于蒸馏烧瓶的支管口处,A、D错误;蒸馏操作中冷凝管的作用是使气体冷凝为液体,为防止馏出液滞留,应选择直形冷凝管,B错误,C正确。
(5)结合已知信息①可知,CaCl₂可与未反应完的乙醇反应生成CaCl₂·6C₂H₅OH,也能与Na₂CO₃反应,故用其洗涤的目的是除去乙醇及Na₂CO₃,a正确。加热一段时间后发现忘记加碎瓷片,应冷却后补加,若直接在加热状态下加入碎瓷片,由于温差,可能会导致溶液飞溅,甚至引发安全事故,b正确。乙酸和乙醇在浓硫酸催化和加热条件下会发生酯化反应生成乙酸乙酯和水,该实验用NaHSO₄固体代替浓硫酸,起催化作用,无吸水作用,c错误。由上述分析可知,反应前变色硅胶为蓝色,反应达到终点时变为粉红色,故变色硅胶可以指示反应进程;此外变色硅胶吸水还可使酯化反应平衡正向移动,提高乙酸乙酯的产率,d正确。
(6)0.1 mol乙酸与0.2 mol乙醇反应时,由于乙醇过量,故根据乙酸的量计算乙酸乙酯的理论产量为0.1 mol×88 g·mol⁻¹ = 8.8 g,则该实验中乙酸乙酯的产率为(6.60 g×96.0%)/8.8 g×100% = 72%。
答案
(1)圆底烧瓶 B
(2)由蓝色变为粉红色
(3)除去乙酸和NaHSO₄(答案合理即可) 干燥乙酸乙酯
(4)C
(5)c
(6)72%
查看更多完整答案,请扫码查看


