2025年天星教育试题调研化学第9辑
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天星教育试题调研化学第9辑 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第40页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
热考指数 ★★★★★
原创预测 2024年12月27日,某车企正式向哈尔滨2025年第九届亚冬会组委会交付350辆醇氢电混汽车,这是甲醇汽车首次大规模服务国际性体育赛事。甲醇作为一种重要的清洁能源,在未来能源领域具有广阔的应用前景。回答下列问题:
(1)反应Ⅰ $ CO_{2}(g)+H_{2}(g)\rightleftharpoons CO(g)+H_{2}O(g) $ $ \Delta H_{1}=+41.0kJ· mol^{-1} $;
反应Ⅱ $ CO_{2}(g)+3H_{2}(g)\rightleftharpoons CH_{3}OH(g)+H_{2}O(g) $ $ \Delta H_{2} $。
①一定温度下,向恒压容器中充入$ 0.2molCO_{2}(g) $、$ 0.6molH_{2}(g) $,该条件下只发生反应Ⅱ,达到平衡时放出7.8kJ的能量,若向相同容器中充入$ 0.4molCH_{3}OH(g) $、$ 0.4molH_{2}O(g) $,在相同条件下达到平衡时,吸收4.0kJ的能量,则反应Ⅱ的$ \Delta H_{2}= $
②$ CO_{2} $加氢合成甲醇过程中,对甲醇的碳源的机理的推测有如下两种。
Ⅰ.$ CO_{2} $与$ H_{2} $作用先生成CO,CO再与氢气合成甲醇:$ CO_{2}\overset{H_{2}}{\underset{H_{2}O}{\rightleftharpoons }}CO\overset{2H_{2}}{\rightleftharpoons }CH_{3}OH $。
Ⅱ.$ CO_{2} $不必转化为CO,可以直接与氢气合成甲醇:$ CO\overset{H_{2}O}{\underset{H_{2}}{\rightleftharpoons }}CO_{2}\overset{3H_{2}}{\underset{H_{2}O}{\rightleftharpoons }}CH_{3}OH $。
压强的影响也可以为反应机理的推测提供重要信息。以$ Cu/ZnO/ZrO_{2} $为催化剂,相同温度下压强从1MPa变化到4MPa时对$ CO_{2} $加氢反应的影响如图2所示,由此推断生成甲醇的机理是Ⅱ(填“Ⅰ”或“Ⅱ”),原因是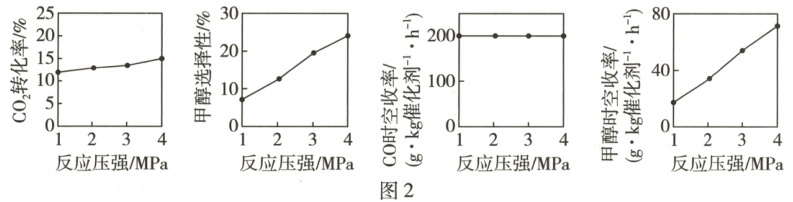
原创预测 2024年12月27日,某车企正式向哈尔滨2025年第九届亚冬会组委会交付350辆醇氢电混汽车,这是甲醇汽车首次大规模服务国际性体育赛事。甲醇作为一种重要的清洁能源,在未来能源领域具有广阔的应用前景。回答下列问题:
(1)反应Ⅰ $ CO_{2}(g)+H_{2}(g)\rightleftharpoons CO(g)+H_{2}O(g) $ $ \Delta H_{1}=+41.0kJ· mol^{-1} $;
反应Ⅱ $ CO_{2}(g)+3H_{2}(g)\rightleftharpoons CH_{3}OH(g)+H_{2}O(g) $ $ \Delta H_{2} $。
①一定温度下,向恒压容器中充入$ 0.2molCO_{2}(g) $、$ 0.6molH_{2}(g) $,该条件下只发生反应Ⅱ,达到平衡时放出7.8kJ的能量,若向相同容器中充入$ 0.4molCH_{3}OH(g) $、$ 0.4molH_{2}O(g) $,在相同条件下达到平衡时,吸收4.0kJ的能量,则反应Ⅱ的$ \Delta H_{2}= $
-49
7.5 17.5
$ kPa· min^{-1} $,反应i的压强平衡常数$ K_{p}= $$\frac{\frac{0.25}{3.6}× 1.8× 10^{3}× \frac{0.2}{3.6}× 1.8× 10^{3}}{(\frac{2.35}{3.6}× 1.8× 10^{3})^{3}× \frac{0.75}{3.6}× 1.8× 10^{3}}$ $\frac{\frac{0.25}{3.6}× 1.8× 10^{3}× \frac{0.2}{3.6}× 1.8× 10^{3}}{(\frac{2.35}{3.6}× 1.8× 10^{3})^{3}× \frac{0.75}{3.6}× 1.8× 10^{3}}$
$ kPa^{-2} $(列出计算式即可)。②$ CO_{2} $加氢合成甲醇过程中,对甲醇的碳源的机理的推测有如下两种。
Ⅰ.$ CO_{2} $与$ H_{2} $作用先生成CO,CO再与氢气合成甲醇:$ CO_{2}\overset{H_{2}}{\underset{H_{2}O}{\rightleftharpoons }}CO\overset{2H_{2}}{\rightleftharpoons }CH_{3}OH $。
Ⅱ.$ CO_{2} $不必转化为CO,可以直接与氢气合成甲醇:$ CO\overset{H_{2}O}{\underset{H_{2}}{\rightleftharpoons }}CO_{2}\overset{3H_{2}}{\underset{H_{2}O}{\rightleftharpoons }}CH_{3}OH $。
压强的影响也可以为反应机理的推测提供重要信息。以$ Cu/ZnO/ZrO_{2} $为催化剂,相同温度下压强从1MPa变化到4MPa时对$ CO_{2} $加氢反应的影响如图2所示,由此推断生成甲醇的机理是Ⅱ(填“Ⅰ”或“Ⅱ”),原因是
随着压强的增大,$ CO_{2} $的转化率增大,甲醇的时空收率和选择性也增大,但是CO的时空收率几乎不变,CO选择性下降,说明甲醇是由$ CO_{2} $直接加氢转化而来,$ CO_{2} $不必转化为CO
。[已知:时空收率是指在给定条件下,单位时间内,单位体积(或质量)催化剂能获得的某一产物的量]
答案:
解析
(1)①一定温度下,向恒压容器中充入$ 0.2molCO_{2}(g) $、$ 0.6molH_{2}(g) $,该条件下只发生反应Ⅱ,达到平衡时放出7.8kJ的能量;若向相同容器中充入$ 0.4molCH_{3}OH(g) $、$ 0.4molH_{2}O(g) $,反应Ⅱ逆向进行,达到平衡时吸收4.0kJ的能量,以上两种情况均是按化学计量数之比投料,则反应Ⅱ的$ \Delta H_{2}=(-7.8-\frac{1}{2}× 4.0)kJ· mol^{-1}× 5=-49kJ· mol^{-1} $。
②由题图1可知,在约$ 250^{\circ}C $时甲醇产量最高。随着温度升高,反应速率加快,反应未达到平衡时,反应相同时间内,甲醇产量增大;由①中分析可知反应Ⅱ为放热反应,达到平衡时,温度升高,平衡逆向移动,故甲醇产量降低。为了提高甲醇产量,工业生产中需要考虑的是影响化学反应速率和限度的外界因素,除了温度,还要考虑压强、氢气与二氧化碳的投料比、催化剂等。
(2)①恒温恒压下,初始时$ n(CO_{2})=1mol $、$ n(H_{2})=3mol $,$ CO_{2} $的平衡转化率为25%,则转化的二氧化碳的物质的量为0.25mol,甲醇的选择性为80%,则$ n_{平}(CH_{3}OH)=0.25mol× 80\%=0.2mol $,假设反应i达到平衡后,再发生反应ii,则可列三段式:
【引思路】一般情况下,对于多反应平衡体系的计算问题,假设其中一个反应先达到平衡后,再发生另一个反应,列三段式进行计算,解题思路更简便。
反应i $ CO_{2}(g)+3H_{2}(g)\rightleftharpoons CH_{3}OH(g)+H_{2}O(g) $
| | $ CO_{2}(g) $ | $ 3H_{2}(g) $ | $ CH_{3}OH(g) $ | $ H_{2}O(g) $ |
|--|--|--|--|--|
| 起始量/mol | 1 | 3 | 0 | 0 |
| 转化量/mol | 0.2 | 0.6 | 0.2 | 0.2 |
| 平衡量/mol | 0.8 | 2.4 | 0.2 | 0.2 |
反应ii $ CO_{2}(g)+H_{2}(g)\rightleftharpoons CO(g)+H_{2}O(g) $
| | $ CO_{2}(g) $ | $ H_{2}(g) $ | $ CO(g) $ | $ H_{2}O(g) $ |
|--|--|--|--|--|
| 起始量/mol | 0.8 | 2.4 | 0 | 0.2 |
| 转化量/mol | $ 0.25 - 0.2 $ | 0.05 | 0.05 | 0.05 |
| 平衡量/mol | 0.75 | 2.35 | 0.05 | 0.25 |
平衡时混合气体的总物质的量为3.6mol,$ H_{2} $的起始分压为$ 1.8× 10^{3}kPa× \frac{3mol}{4mol}=1350kPa $,平衡时$ H_{2} $的分压为$ 1.8× 10^{3}kPa× \frac{2.35mol}{3.6mol}=1175kPa $,则$ 0\sim 10min $内,$ H_{2} $的平均反应速率为$ \frac{1350kPa - 1175kPa}{10min}=17.5kPa· min^{-1} $,反应i的压强平衡常数$ K_{p}=\frac{p(H_{2}O)· p(CH_{3}OH)}{p^{3}(H_{2})· p(CO_{2})}=\frac{\frac{0.25}{3.6}× 1.8× 10^{3}× \frac{0.2}{3.6}× 1.8× 10^{3}}{(\frac{2.35}{3.6}× 1.8× 10^{3})^{3}× \frac{0.75}{3.6}× 1.8× 10^{3}}kPa^{-2} $。②由题图2可知,随着压强的增大,$ CO_{2} $的转化率增大,甲醇的时空收率和选择性也增大,但是CO的时空收率几乎不变,CO选择性下降,可以推断甲醇是由$ CO_{2} $直接加氢转化而来,$ CO_{2} $不必转化为CO。
答案
(1)①-49 ②$ 250^{\circ}C $ 见解析 压强、催化剂(答案合理即可)
(2)①17.5 $ \frac{\frac{0.25}{3.6}× 1.8× 10^{3}× \frac{0.2}{3.6}× 1.8× 10^{3}}{(\frac{2.35}{3.6}× 1.8× 10^{3})^{3}× \frac{0.75}{3.6}× 1.8× 10^{3}} $ ②Ⅱ 见解析
(1)①一定温度下,向恒压容器中充入$ 0.2molCO_{2}(g) $、$ 0.6molH_{2}(g) $,该条件下只发生反应Ⅱ,达到平衡时放出7.8kJ的能量;若向相同容器中充入$ 0.4molCH_{3}OH(g) $、$ 0.4molH_{2}O(g) $,反应Ⅱ逆向进行,达到平衡时吸收4.0kJ的能量,以上两种情况均是按化学计量数之比投料,则反应Ⅱ的$ \Delta H_{2}=(-7.8-\frac{1}{2}× 4.0)kJ· mol^{-1}× 5=-49kJ· mol^{-1} $。
②由题图1可知,在约$ 250^{\circ}C $时甲醇产量最高。随着温度升高,反应速率加快,反应未达到平衡时,反应相同时间内,甲醇产量增大;由①中分析可知反应Ⅱ为放热反应,达到平衡时,温度升高,平衡逆向移动,故甲醇产量降低。为了提高甲醇产量,工业生产中需要考虑的是影响化学反应速率和限度的外界因素,除了温度,还要考虑压强、氢气与二氧化碳的投料比、催化剂等。
(2)①恒温恒压下,初始时$ n(CO_{2})=1mol $、$ n(H_{2})=3mol $,$ CO_{2} $的平衡转化率为25%,则转化的二氧化碳的物质的量为0.25mol,甲醇的选择性为80%,则$ n_{平}(CH_{3}OH)=0.25mol× 80\%=0.2mol $,假设反应i达到平衡后,再发生反应ii,则可列三段式:
【引思路】一般情况下,对于多反应平衡体系的计算问题,假设其中一个反应先达到平衡后,再发生另一个反应,列三段式进行计算,解题思路更简便。
反应i $ CO_{2}(g)+3H_{2}(g)\rightleftharpoons CH_{3}OH(g)+H_{2}O(g) $
| | $ CO_{2}(g) $ | $ 3H_{2}(g) $ | $ CH_{3}OH(g) $ | $ H_{2}O(g) $ |
|--|--|--|--|--|
| 起始量/mol | 1 | 3 | 0 | 0 |
| 转化量/mol | 0.2 | 0.6 | 0.2 | 0.2 |
| 平衡量/mol | 0.8 | 2.4 | 0.2 | 0.2 |
反应ii $ CO_{2}(g)+H_{2}(g)\rightleftharpoons CO(g)+H_{2}O(g) $
| | $ CO_{2}(g) $ | $ H_{2}(g) $ | $ CO(g) $ | $ H_{2}O(g) $ |
|--|--|--|--|--|
| 起始量/mol | 0.8 | 2.4 | 0 | 0.2 |
| 转化量/mol | $ 0.25 - 0.2 $ | 0.05 | 0.05 | 0.05 |
| 平衡量/mol | 0.75 | 2.35 | 0.05 | 0.25 |
平衡时混合气体的总物质的量为3.6mol,$ H_{2} $的起始分压为$ 1.8× 10^{3}kPa× \frac{3mol}{4mol}=1350kPa $,平衡时$ H_{2} $的分压为$ 1.8× 10^{3}kPa× \frac{2.35mol}{3.6mol}=1175kPa $,则$ 0\sim 10min $内,$ H_{2} $的平均反应速率为$ \frac{1350kPa - 1175kPa}{10min}=17.5kPa· min^{-1} $,反应i的压强平衡常数$ K_{p}=\frac{p(H_{2}O)· p(CH_{3}OH)}{p^{3}(H_{2})· p(CO_{2})}=\frac{\frac{0.25}{3.6}× 1.8× 10^{3}× \frac{0.2}{3.6}× 1.8× 10^{3}}{(\frac{2.35}{3.6}× 1.8× 10^{3})^{3}× \frac{0.75}{3.6}× 1.8× 10^{3}}kPa^{-2} $。②由题图2可知,随着压强的增大,$ CO_{2} $的转化率增大,甲醇的时空收率和选择性也增大,但是CO的时空收率几乎不变,CO选择性下降,可以推断甲醇是由$ CO_{2} $直接加氢转化而来,$ CO_{2} $不必转化为CO。
答案
(1)①-49 ②$ 250^{\circ}C $ 见解析 压强、催化剂(答案合理即可)
(2)①17.5 $ \frac{\frac{0.25}{3.6}× 1.8× 10^{3}× \frac{0.2}{3.6}× 1.8× 10^{3}}{(\frac{2.35}{3.6}× 1.8× 10^{3})^{3}× \frac{0.75}{3.6}× 1.8× 10^{3}} $ ②Ⅱ 见解析
查看更多完整答案,请扫码查看


