2025年天星教育试题调研化学第9辑
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天星教育试题调研化学第9辑 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第72页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
热考指数 ★★★★★
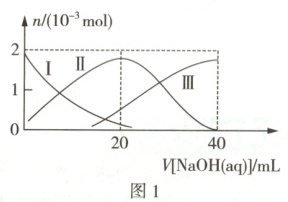
原创预测 常温下,向20mL0.1mol·L⁻¹H₂A溶液中滴加0.1mol·L⁻¹NaOH溶液,含A微粒的物质的量、混合溶液的pH随V[NaOH(aq)]的变化分别如图1和图2所示(忽略溶液体积的变化)。
下列说法错误的是
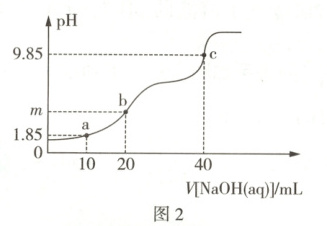
A.图2中m < 7
B.a点对应溶液中:c(HA⁻) > c(H₂A) > c(A²⁻)
C.当溶液的pH = 7时,c(Na⁺) > c(HA⁻) + 2c(A²⁻)
D.H₂A的第二步电离平衡常数Kₐ₂(H₂A)约为$\frac{10^{-6.7}}{3}$
原创预测 常温下,向20mL0.1mol·L⁻¹H₂A溶液中滴加0.1mol·L⁻¹NaOH溶液,含A微粒的物质的量、混合溶液的pH随V[NaOH(aq)]的变化分别如图1和图2所示(忽略溶液体积的变化)。
下列说法错误的是


A.图2中m < 7
B.a点对应溶液中:c(HA⁻) > c(H₂A) > c(A²⁻)
C.当溶液的pH = 7时,c(Na⁺) > c(HA⁻) + 2c(A²⁻)
D.H₂A的第二步电离平衡常数Kₐ₂(H₂A)约为$\frac{10^{-6.7}}{3}$
答案:
解析
由题意可知,滴定过程中发生的反应依次为H₂A + NaOH = NaHA + H₂O、NaHA + NaOH = Na₂A + H₂O,故题图1中曲线Ⅰ、Ⅱ、Ⅲ分别表示H₂A、HA⁻、A²⁻的物质的量随V[NaOH(aq)]的变化。V[NaOH(aq)] = 20mL时,所得溶液溶质为NaHA,由题图1可知,此时该溶液中c(HA⁻) > c(A²⁻) > c(H₂A),则HA⁻的电离程度大于其水解程度,故b点对应溶液显酸性,则题图乙中m < 7,A正确。a点对应溶液为等浓度的H₂A和NaHA的混合
【解题突破】对于双电解质溶液图像,可以先通过两图中共用条件建立起两个图像间的联系,然后快速判断出相关微粒浓度关系等,进而判断选项。
溶液,根据Kₐ₁(H₂A) > Kₐ₂(H₂A),则c(HA⁻) > c(H₂A) > c(A²⁻),B正确。常温下,当溶液的pH = 7时,c(H⁺) = c(OH⁻),根据电荷守恒可知,溶液中c(Na⁺) + c(H⁺) = c(HA⁻) + 2c(A²⁻) + c(OH⁻),则c(Na⁺) = c(HA⁻) + 2c(A²⁻),C错误。根据题图2可知c点对应溶液溶质为Na₂A,此时c(Na₂A) = $\frac{1}{30}$mol·L⁻¹,pH = 9.85,则c(OH⁻) = 10⁻⁴.¹⁵mol·L⁻¹,Kₕ(A²⁻) = $\frac{c(HA^{-})·c(OH^{-})}{c(A^{2-})}$ ≈ $\frac{c^{2}(OH^{-})}{c(A^{2-})}$ = 3×10⁻⁷.³,Kₐ₂(H₂A) = $\frac{c(A^{2-})·c(H^{+})}{c(HA^{-})}$ = $\frac{c(A^{2-})·c(H^{+})·c(OH^{-})}{c(HA^{-})·c(OH^{-})}$ = $\frac{K_{W}}{K_{h}(A^{2-})}$ = $\frac{10^{-14}}{3×10^{-7.3}}$ = $\frac{10^{-6.7}}{3}$,D正确。
由题意可知,滴定过程中发生的反应依次为H₂A + NaOH = NaHA + H₂O、NaHA + NaOH = Na₂A + H₂O,故题图1中曲线Ⅰ、Ⅱ、Ⅲ分别表示H₂A、HA⁻、A²⁻的物质的量随V[NaOH(aq)]的变化。V[NaOH(aq)] = 20mL时,所得溶液溶质为NaHA,由题图1可知,此时该溶液中c(HA⁻) > c(A²⁻) > c(H₂A),则HA⁻的电离程度大于其水解程度,故b点对应溶液显酸性,则题图乙中m < 7,A正确。a点对应溶液为等浓度的H₂A和NaHA的混合
【解题突破】对于双电解质溶液图像,可以先通过两图中共用条件建立起两个图像间的联系,然后快速判断出相关微粒浓度关系等,进而判断选项。
溶液,根据Kₐ₁(H₂A) > Kₐ₂(H₂A),则c(HA⁻) > c(H₂A) > c(A²⁻),B正确。常温下,当溶液的pH = 7时,c(H⁺) = c(OH⁻),根据电荷守恒可知,溶液中c(Na⁺) + c(H⁺) = c(HA⁻) + 2c(A²⁻) + c(OH⁻),则c(Na⁺) = c(HA⁻) + 2c(A²⁻),C错误。根据题图2可知c点对应溶液溶质为Na₂A,此时c(Na₂A) = $\frac{1}{30}$mol·L⁻¹,pH = 9.85,则c(OH⁻) = 10⁻⁴.¹⁵mol·L⁻¹,Kₕ(A²⁻) = $\frac{c(HA^{-})·c(OH^{-})}{c(A^{2-})}$ ≈ $\frac{c^{2}(OH^{-})}{c(A^{2-})}$ = 3×10⁻⁷.³,Kₐ₂(H₂A) = $\frac{c(A^{2-})·c(H^{+})}{c(HA^{-})}$ = $\frac{c(A^{2-})·c(H^{+})·c(OH^{-})}{c(HA^{-})·c(OH^{-})}$ = $\frac{K_{W}}{K_{h}(A^{2-})}$ = $\frac{10^{-14}}{3×10^{-7.3}}$ = $\frac{10^{-6.7}}{3}$,D正确。
查看更多完整答案,请扫码查看


