2025年天星教育试题调研化学第9辑
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天星教育试题调研化学第9辑 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第37页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
原创预测 某研究小组为了测定某铁矿石粉中铁、氧的含量,设计实验如下。
[铁矿石粉中氧含量的测定]
按图组装仪器,检查装置的气密性;按图加入药品,硬质玻璃管中加入5.0g铁矿石粉;装置A中开始反应,待装置D出口处气体验纯后,点燃装置C中酒精灯;充分反应后,熄灭酒精灯,装置A中反应持续进行直至装置冷却。测得反应后装置D增重x g。
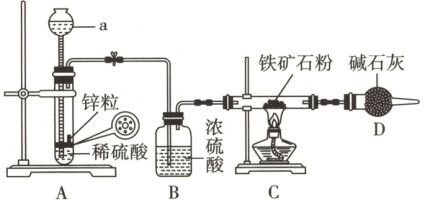
[铁矿石粉中铁含量的测定]
①称取5.0g铁矿石粉于250mL烧杯中,加入35mL浓盐酸,盖上表面皿,在通风橱中低温加热,完全溶解试样,将溶解液冷却后,转移到250mL容量瓶中,稀释到刻度并摇匀。
②量取25.00mL试样溶液于锥形瓶中,加入适量浓盐酸,加热,加入6滴甲基橙(可被Sn²⁺还原而褪色),趁热边摇动锥形瓶边滴加SnCl₂溶液还原Fe³⁺,待溶液由橙色变为接近无色时停止滴加。
③立即用冰水冷却,加入60mL蒸馏水,25mL硫酸、磷酸的混合酸,4滴二苯胺磺酸钠(指示剂,还原态溶液为无色,可被K₂Cr₂O₇氧化,氧化态溶液显紫红色),立即用c mol·L⁻¹K₂Cr₂O₇标准溶液滴定至终点,重复实验三次,消耗K₂Cr₂O₇标准溶液的体积依次为V₁mL、V₂mL、V₃mL(测定值均在误差范围内)。
已知:在该实验条件下,Cl⁻不会被K₂Cr₂O₇氧化;Fe³⁺可与PO₄³⁻反应生成无色的[Fe(PO₄)₂]³⁻。
回答下列问题:
(1)仪器a的名称是24c(V₁ + V₂ + V₃)g·kg⁻¹(用含c、V₁、V₂、V₃的代数式表示)。若滴定过慢,会使测定结果偏低(填“偏高”“偏低”或“无影响”)。
[铁矿石粉中氧含量的测定]
按图组装仪器,检查装置的气密性;按图加入药品,硬质玻璃管中加入5.0g铁矿石粉;装置A中开始反应,待装置D出口处气体验纯后,点燃装置C中酒精灯;充分反应后,熄灭酒精灯,装置A中反应持续进行直至装置冷却。测得反应后装置D增重x g。

[铁矿石粉中铁含量的测定]
①称取5.0g铁矿石粉于250mL烧杯中,加入35mL浓盐酸,盖上表面皿,在通风橱中低温加热,完全溶解试样,将溶解液冷却后,转移到250mL容量瓶中,稀释到刻度并摇匀。
②量取25.00mL试样溶液于锥形瓶中,加入适量浓盐酸,加热,加入6滴甲基橙(可被Sn²⁺还原而褪色),趁热边摇动锥形瓶边滴加SnCl₂溶液还原Fe³⁺,待溶液由橙色变为接近无色时停止滴加。
③立即用冰水冷却,加入60mL蒸馏水,25mL硫酸、磷酸的混合酸,4滴二苯胺磺酸钠(指示剂,还原态溶液为无色,可被K₂Cr₂O₇氧化,氧化态溶液显紫红色),立即用c mol·L⁻¹K₂Cr₂O₇标准溶液滴定至终点,重复实验三次,消耗K₂Cr₂O₇标准溶液的体积依次为V₁mL、V₂mL、V₃mL(测定值均在误差范围内)。
已知:在该实验条件下,Cl⁻不会被K₂Cr₂O₇氧化;Fe³⁺可与PO₄³⁻反应生成无色的[Fe(PO₄)₂]³⁻。
回答下列问题:
(1)仪器a的名称是24c(V₁ + V₂ + V₃)g·kg⁻¹(用含c、V₁、V₂、V₃的代数式表示)。若滴定过慢,会使测定结果偏低(填“偏高”“偏低”或“无影响”)。
答案:
解析
(1)仪器a的名称是长颈漏斗。
(2)装置A用于制备氢气,装置B用于干燥氢气,装置C中氢气与铁矿石粉发生反应,装置D用于吸收装置C中产生的水蒸气,但空气中的水蒸气和CO₂也会进入装置D,故测定铁矿石粉中氧含量的装置的缺陷是装置D后缺少一个盛装碱石灰的干燥装置。对装置进行改进后,测得反应后装置D增重y g,即吸收H₂O的质量为y g,H₂O中的O来自铁矿石粉,m(O) = $\frac{y}{18}$×16 g = $\frac{8y}{9}$g,则铁矿石粉中氧的含量为$\frac{\frac{8y}{9}g}{5.0g}$×100% = $\frac{160y}{9}$%。
(3)用浓盐酸溶解试样时,需要“低温加热”,且加热温度不宜过高;若不加热,溶解速率慢;若加热温度过高,浓盐酸大量挥发,不利于试样的溶解。
(4)滴定过程中,K₂Cr₂O₇将Fe²⁺氧化为Fe³⁺,K₂Cr₂O₇本身被还原为Cr³⁺,反应的离子方程式为Cr₂O₇²⁻ + 6Fe²⁺ + 14H⁺ = 6Fe³⁺ + 2Cr³⁺ + 7H₂O。根据题干信息可知,二苯胺磺酸钠指示剂可被K₂Cr₂O₇氧化,氧化态溶液显紫红色,则达到滴定终点时的现象为当滴入最后半滴K₂Cr₂O₇标准溶液,溶液由接近无色变为紫红色,且30 s内不褪色。
(5)根据题给已知信息可知,Fe³⁺可与PO₄³⁻反应生成无色的[Fe(PO₄)₂]³⁻,则磷酸的作用为电离出PO₄³⁻,PO₄³⁻与Fe³⁺反应生成无色的[Fe(PO₄)₂]³⁻,防止Fe³⁺的颜色影响滴定终点的判断。
(6)由题意可知,滴定至终点时消耗K₂Cr₂O₇标准溶液的平均体积为$\frac{V₁ + V₂ + V₃}{3×1000}$L,根据滴定反应可得关系式Cr₂O₇²⁻ ~ 6Fe²⁺,则25.00mL试样溶液中含有铁元素的质量为$\frac{56×6c(V₁ + V₂ + V₃)}{3×1000}$g。则5.0g该铁矿石粉中含有铁元素的质量为$\frac{56×6c(V₁ + V₂ + V₃)×\frac{250}{25.00}}{3×1000}$g,该铁矿石粉中铁的含量为$\frac{56×6×10c(V₁ + V₂ + V₃)}{3×1000×5.0}$×1000 g·kg⁻¹ = 224c(V₁ + V₂ + V₃)g·kg⁻¹。若滴定过慢,时间过长,部分Fe²⁺会被空气中的氧气氧化为Fe³⁺,导致消耗的K₂Cr₂O₇标准溶液的体积偏小,使测定结果偏低。
答案
(1)长颈漏斗
(2)装置D后缺少一个盛装碱石灰的干燥装置 $\frac{160y}{9}$
(3)若不加热,溶解速率慢;若加热温度过高,浓盐酸大量挥发,不利于试样的溶解
(4)Cr₂O₇²⁻ + 6Fe²⁺ + 14H⁺ = 6Fe³⁺ + 2Cr³⁺ + 7H₂O 当滴入最后半滴K₂Cr₂O₇标准溶液,溶液由接近无色变为紫红色,且30 s内不褪色
(5)电离出PO₄³⁻,PO₄³⁻与Fe³⁺反应生成无色的[Fe(PO₄)₂]³⁻,防止Fe³⁺的颜色影响滴定终点的判断
(6)224c(V₁ + V₂ + V₃) 偏低
(1)仪器a的名称是长颈漏斗。
(2)装置A用于制备氢气,装置B用于干燥氢气,装置C中氢气与铁矿石粉发生反应,装置D用于吸收装置C中产生的水蒸气,但空气中的水蒸气和CO₂也会进入装置D,故测定铁矿石粉中氧含量的装置的缺陷是装置D后缺少一个盛装碱石灰的干燥装置。对装置进行改进后,测得反应后装置D增重y g,即吸收H₂O的质量为y g,H₂O中的O来自铁矿石粉,m(O) = $\frac{y}{18}$×16 g = $\frac{8y}{9}$g,则铁矿石粉中氧的含量为$\frac{\frac{8y}{9}g}{5.0g}$×100% = $\frac{160y}{9}$%。
(3)用浓盐酸溶解试样时,需要“低温加热”,且加热温度不宜过高;若不加热,溶解速率慢;若加热温度过高,浓盐酸大量挥发,不利于试样的溶解。
(4)滴定过程中,K₂Cr₂O₇将Fe²⁺氧化为Fe³⁺,K₂Cr₂O₇本身被还原为Cr³⁺,反应的离子方程式为Cr₂O₇²⁻ + 6Fe²⁺ + 14H⁺ = 6Fe³⁺ + 2Cr³⁺ + 7H₂O。根据题干信息可知,二苯胺磺酸钠指示剂可被K₂Cr₂O₇氧化,氧化态溶液显紫红色,则达到滴定终点时的现象为当滴入最后半滴K₂Cr₂O₇标准溶液,溶液由接近无色变为紫红色,且30 s内不褪色。
(5)根据题给已知信息可知,Fe³⁺可与PO₄³⁻反应生成无色的[Fe(PO₄)₂]³⁻,则磷酸的作用为电离出PO₄³⁻,PO₄³⁻与Fe³⁺反应生成无色的[Fe(PO₄)₂]³⁻,防止Fe³⁺的颜色影响滴定终点的判断。
(6)由题意可知,滴定至终点时消耗K₂Cr₂O₇标准溶液的平均体积为$\frac{V₁ + V₂ + V₃}{3×1000}$L,根据滴定反应可得关系式Cr₂O₇²⁻ ~ 6Fe²⁺,则25.00mL试样溶液中含有铁元素的质量为$\frac{56×6c(V₁ + V₂ + V₃)}{3×1000}$g。则5.0g该铁矿石粉中含有铁元素的质量为$\frac{56×6c(V₁ + V₂ + V₃)×\frac{250}{25.00}}{3×1000}$g,该铁矿石粉中铁的含量为$\frac{56×6×10c(V₁ + V₂ + V₃)}{3×1000×5.0}$×1000 g·kg⁻¹ = 224c(V₁ + V₂ + V₃)g·kg⁻¹。若滴定过慢,时间过长,部分Fe²⁺会被空气中的氧气氧化为Fe³⁺,导致消耗的K₂Cr₂O₇标准溶液的体积偏小,使测定结果偏低。
答案
(1)长颈漏斗
(2)装置D后缺少一个盛装碱石灰的干燥装置 $\frac{160y}{9}$
(3)若不加热,溶解速率慢;若加热温度过高,浓盐酸大量挥发,不利于试样的溶解
(4)Cr₂O₇²⁻ + 6Fe²⁺ + 14H⁺ = 6Fe³⁺ + 2Cr³⁺ + 7H₂O 当滴入最后半滴K₂Cr₂O₇标准溶液,溶液由接近无色变为紫红色,且30 s内不褪色
(5)电离出PO₄³⁻,PO₄³⁻与Fe³⁺反应生成无色的[Fe(PO₄)₂]³⁻,防止Fe³⁺的颜色影响滴定终点的判断
(6)224c(V₁ + V₂ + V₃) 偏低
查看更多完整答案,请扫码查看


