2025年天星教育试题调研化学第9辑
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天星教育试题调研化学第9辑 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第60页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
原创预测1 中国科学院和郑州大学的科研人员发明了一种利用CuTa⁺介导催化CH₄和CO₂耦联形成乙烯酮(CH₂=C=O)的方法,对温室气体的控制与资源化利用具有重要意义,该方法的反应机理如图所示。下列说法正确的是
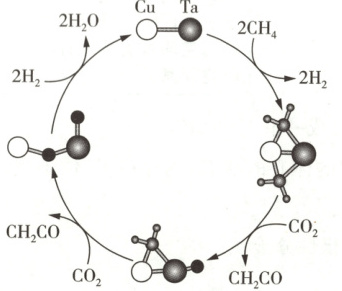
A.乙烯酮中碳原子的杂化类型和丙炔中碳原子的杂化类型相同
B.该反应的中间产物有H₂和H₂O
C.总反应式为CH₄ + CO₂ = CH₂CO + H₂O
D.CH₄和H₂O的VSEPR模型相同,但CH₄的键角小于H₂O的键角

A.乙烯酮中碳原子的杂化类型和丙炔中碳原子的杂化类型相同
B.该反应的中间产物有H₂和H₂O
C.总反应式为CH₄ + CO₂ = CH₂CO + H₂O
D.CH₄和H₂O的VSEPR模型相同,但CH₄的键角小于H₂O的键角
答案:
解析 乙烯酮(CH₂=C=O)中有1个碳原子形成2个双键,采取sp杂化,另1个碳原子形成1个双键和2个单键,采取sp²杂化;丙炔(CH₃ - C≡CH)中有2个碳原子均形成1个单键和1个三键,采取sp杂化,剩余1个碳原子形成4个单键,采取sp³杂化,A错误。由题图可知,H₂O在反应历程中只生成不消耗,为产物,而H₂先生成后被消耗,为中间产物,故该反应的中间产物只有H₂,B错误。根据题图可知,该反应的反应物为CH₄和CO₂,产物【口诀速记】催化剂“先消耗,后生成,反应前后不变样”,中间产物“先生成,后消耗,反应结束找不到”。CH₂CO为和H₂O,则总反应式为CH₄ + CO₂ = CH₂CO + H₂O,C正确。CH₄和H₂O的VSEPR模型都是四面体形,但CH₄的中心碳原子上没有孤电子对,H₂O的中心氧原子上有两对孤电子对,孤电子对对成键电子对的斥力大于成键电子对间的斥力,导致键角变小,所以CH₄的键角大于H₂O的,D错误。
原创预测2 在全球气候变化背景下,二氧化碳减排与综合利用已成为科研领域的焦点,我国科研人员高度重视相关研究工作,全力推进“双碳”目标的实现。目前,围绕二氧化碳转化利用的研究不断深入,旨在探寻高效、可持续的技术路径。其中,对CO₂和H₂在特定催化剂表面合成甲醇[CO₂(g) + 3H₂(g) ⇌ CH₃OH(g) + H₂O(g) ΔH]的研究已取得了突破性的进展,其反应历程如图所示,吸附在催化剂表面的物种用*标注。

A.该反应在高温下一定能自发进行
B.升高温度,基元反应HCOO* + 5H* = HCOOH + 4H*的正反应速率增加的程度小于逆反应速率增加的程度
C.最后一步基元反应过程中有极性键的断裂和生成
D.基元反应CH₂O* + H* = CH₃O*是快反应

A.该反应在高温下一定能自发进行
B.升高温度,基元反应HCOO* + 5H* = HCOOH + 4H*的正反应速率增加的程度小于逆反应速率增加的程度
C.最后一步基元反应过程中有极性键的断裂和生成
D.基元反应CH₂O* + H* = CH₃O*是快反应
答案:
解析 由题图可知,反应物的总能量高于生成物的总能量,说明该反应是放热反应,即ΔH < 0;该反应为反应前后气体分子数减小的反应,即ΔS < 0,由ΔG = ΔH - TΔS < 0时反应自发进行可知,该反应在低温下能自发进行,在高温下不一定能自发进行,A错误。基元反应HCOO* + 5H* = HCOOH + 4H*中,反应物的总能量低于生成物的总能量,说明该基元反应吸热,升高温度,正、逆反应速率均增加,平衡向正反应方向移动,故正反应速率增加的程度比逆反应速率增加的程度大,B错误。最后一步基元反应是OH* + H* = H₂O*,此过程中形成氢氧键,只有极性键的生成,没有极性键的断裂,C错误。从题图中可以看出,CH₂O* + OH* + 3H* → CH₃O* + OH* + 2H*的过程能垒最低,即CH₂O* + H* = CH₃O*是该反应历程中活化能最小的反应,是快反应,D正确。
【易错警示】过渡态物质总能量和反应物总能量的差值为活化能,“峰”越高活化能越大,“峰”越低活化能越小。
【易错警示】过渡态物质总能量和反应物总能量的差值为活化能,“峰”越高活化能越大,“峰”越低活化能越小。
查看更多完整答案,请扫码查看


