第31页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
11. 松花蛋也叫皮蛋,是人们喜爱的食品。小明对妈妈用皮蛋粉制作皮蛋的过程产生了浓厚的兴趣,于是以“皮蛋制作”为主题开展项目式学习。
(1) 配制皮蛋粉。在妈妈的指导下,小明将“石灰”、纯碱和食盐按照一定比例混合,制成皮蛋粉。
【提出问题】
配料中所用“石灰”是生石灰还是熟石灰?
【查阅资料】
相同条件下,生石灰、熟石灰与水混合后均能放出热量,但放出的热量不同。
【实验探究】
常温下,将“石灰”、生石灰和熟石灰分别加入水中,测量固体加入前后温度的变化情况。实验过程中需要保持不变的量是
【数据分析】
根据数据比对可知,配料中的“石灰”为生石灰。
(2) 浸鲜蛋。向配制的皮蛋粉中加入一定量的水,充分反应后过滤,所得滤液称为浸出液,将新鲜鸭蛋放入其中浸泡即可。
① 向皮蛋粉中加水时,发生反应的化学方程式为
② 妈妈告诉小明,制作过程中一定要戴上胶皮手套。分析上述过程,小明认为浸出液中一定含有的会腐蚀皮肤的物质是
③ 小明进行了如下探究,请填写下表(不考虑生石灰中杂质的影响)。
浸出液中含碳酸钠 取少量浸出液于试管中,滴加足量稀盐酸 无气泡产生 浸出液中不含碳酸钠
浸出液中含氢氧化钙 取少量浸出液于试管中,通入二氧化碳气体 溶液变浑浊 浸出液中含氢氧化钙
④ 综合分析,确定皮蛋浸出液中的溶质有
(3) 品皮蛋。制作过程中,碱液会渗入皮蛋,使之略带涩味。妈妈告诉小明食用时可以蘸少量食醋去除涩味,该化学反应的微观实质是
(1) 配制皮蛋粉。在妈妈的指导下,小明将“石灰”、纯碱和食盐按照一定比例混合,制成皮蛋粉。
【提出问题】
配料中所用“石灰”是生石灰还是熟石灰?
【查阅资料】
相同条件下,生石灰、熟石灰与水混合后均能放出热量,但放出的热量不同。
【实验探究】
常温下,将“石灰”、生石灰和熟石灰分别加入水中,测量固体加入前后温度的变化情况。实验过程中需要保持不变的量是
水的质量、固体的质量
。【数据分析】
根据数据比对可知,配料中的“石灰”为生石灰。
(2) 浸鲜蛋。向配制的皮蛋粉中加入一定量的水,充分反应后过滤,所得滤液称为浸出液,将新鲜鸭蛋放入其中浸泡即可。
① 向皮蛋粉中加水时,发生反应的化学方程式为
CaO + H₂O = Ca(OH)₂;Ca(OH)₂ + Na₂CO₃ = CaCO₃↓ + 2NaOH
。② 妈妈告诉小明,制作过程中一定要戴上胶皮手套。分析上述过程,小明认为浸出液中一定含有的会腐蚀皮肤的物质是
NaOH
(填化学式)。③ 小明进行了如下探究,请填写下表(不考虑生石灰中杂质的影响)。
浸出液中含碳酸钠 取少量浸出液于试管中,滴加足量稀盐酸 无气泡产生 浸出液中不含碳酸钠
浸出液中含氢氧化钙 取少量浸出液于试管中,通入二氧化碳气体 溶液变浑浊 浸出液中含氢氧化钙
④ 综合分析,确定皮蛋浸出液中的溶质有
NaCl、NaOH、Ca(OH)₂
(写化学式)。(3) 品皮蛋。制作过程中,碱液会渗入皮蛋,使之略带涩味。妈妈告诉小明食用时可以蘸少量食醋去除涩味,该化学反应的微观实质是
氢离子和氢氧根离子结合生成水分子
。该反应实质在生产生活中应用广泛,请再列举一例:用熟石灰改良酸性土壤
。
答案:
(1) 水的质量、固体的质量
(2) ① CaO + H₂O = Ca(OH)₂;Ca(OH)₂ + Na₂CO₃ = CaCO₃↓ + 2NaOH
② NaOH
③
浸出液中含碳酸钠 取少量浸出液于试管中,滴加足量稀盐酸 无气泡产生 浸出液中不含碳酸钠
浸出液中含氢氧化钙 取少量浸出液于试管中,通入二氧化碳气体 溶液变浑浊 浸出液中含氢氧化钙
④ NaCl、NaOH、Ca(OH)₂
(3) 氢离子和氢氧根离子结合生成水分子;用熟石灰改良酸性土壤
(1) 水的质量、固体的质量
(2) ① CaO + H₂O = Ca(OH)₂;Ca(OH)₂ + Na₂CO₃ = CaCO₃↓ + 2NaOH
② NaOH
③
浸出液中含碳酸钠 取少量浸出液于试管中,滴加足量稀盐酸 无气泡产生 浸出液中不含碳酸钠
浸出液中含氢氧化钙 取少量浸出液于试管中,通入二氧化碳气体 溶液变浑浊 浸出液中含氢氧化钙
④ NaCl、NaOH、Ca(OH)₂
(3) 氢离子和氢氧根离子结合生成水分子;用熟石灰改良酸性土壤
12. 《天工开物》记载的古法造纸术的流程是原料浸泡、蒸煮、抄制、烘干。兴趣小组根据记载,利用回收的废纸进行“制造再生纸”跨学科实践活动,在蒸煮时加入了氢氧化钠。造纸后,为处理剩余的废液,进行如下探究活动。
【查阅资料】
① $BaCl_{2}+Na_{2}CO_{3}= BaCO_{3}\downarrow +2NaCl$; ② $BaCl_{2}$ 溶液呈中性; ③ 碱石灰是氢氧化钠与氧化钙的固体混合物,能吸收水和二氧化碳。
【任务一】废液成分分析
【提出猜想】推测废液中含有氢氧化钠和碳酸钠中的一种或两种
【实验设计与实施】

【任务二】废液中碳酸钠含量的测定
兴趣小组设计了如图所示的实验,取 $100\ g$ 废液样品,放入装置 A 的锥形瓶中。先通入一会儿 $N_{2}$,然后称量装置 C、D 的质量,再向锥形瓶中滴加足量稀硫酸至不再产生气体,继续通入一会儿 $N_{2}$ 后,测得装置 C、D 的质量分别增加 $2.1\ g$ 和 $0.1\ g$。
(1) 锥形瓶中不再产生气体后,需要继续通入一会儿 $N_{2}$,其原因是
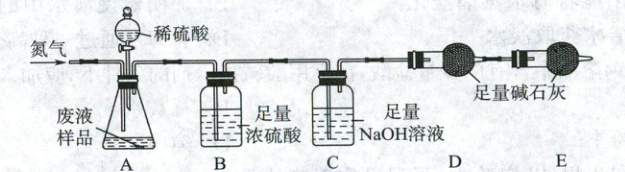
(2) 装置 C 中发生反应的化学方程式是
(3) 废液中碳酸钠的溶质质量分数是
(4) 如果缺少装置 B,会使测定的碳酸钠的含量
【任务三】废液的处理
(5) 为使废液中的碳酸钠转化为氢氧化钠循环利用,需根据废液中碳酸钠的含量,加入一定量的某种物质。该物质与碳酸钠反应的化学方程式是
【查阅资料】
① $BaCl_{2}+Na_{2}CO_{3}= BaCO_{3}\downarrow +2NaCl$; ② $BaCl_{2}$ 溶液呈中性; ③ 碱石灰是氢氧化钠与氧化钙的固体混合物,能吸收水和二氧化碳。
【任务一】废液成分分析
【提出猜想】推测废液中含有氢氧化钠和碳酸钠中的一种或两种
【实验设计与实施】

【任务二】废液中碳酸钠含量的测定
兴趣小组设计了如图所示的实验,取 $100\ g$ 废液样品,放入装置 A 的锥形瓶中。先通入一会儿 $N_{2}$,然后称量装置 C、D 的质量,再向锥形瓶中滴加足量稀硫酸至不再产生气体,继续通入一会儿 $N_{2}$ 后,测得装置 C、D 的质量分别增加 $2.1\ g$ 和 $0.1\ g$。
(1) 锥形瓶中不再产生气体后,需要继续通入一会儿 $N_{2}$,其原因是
将生成的二氧化碳全部排入装置C、D中,使其完全被吸收
。
(2) 装置 C 中发生反应的化学方程式是
$2NaOH + CO_{2}=Na_{2}CO_{3}+H_{2}O$
。(3) 废液中碳酸钠的溶质质量分数是
5.3%
(精确到 $0.1\%$)。(4) 如果缺少装置 B,会使测定的碳酸钠的含量
偏大
(填“偏大”或“偏小”)。【任务三】废液的处理
(5) 为使废液中的碳酸钠转化为氢氧化钠循环利用,需根据废液中碳酸钠的含量,加入一定量的某种物质。该物质与碳酸钠反应的化学方程式是
$Ca(OH)_{2}+Na_{2}CO_{3}=CaCO_{3}\downarrow + 2NaOH$
。
答案:
【任务一】
步骤1:取少量废液于试管中,加入足量的氯化钡稀溶液 产生白色沉淀 废液中有$Na_{2}CO_{3}$
步骤2:取少量步骤1中的上层清液于试管中,滴加酚酞试液 溶液变红 m 废液中有$NaOH$
【任务二】
(1)将生成的二氧化碳全部排入装置C、D中,使其完全被吸收。
(2)$2NaOH + CO_{2}=Na_{2}CO_{3}+H_{2}O$
(3)解:设废液中碳酸钠的质量为$x$。
装置C、D增加的质量为生成二氧化碳的质量,即$m(CO_{2}) = 2.1g + 0.1g = 2.2g$
$Na_{2}CO_{3}+H_{2}SO_{4}=Na_{2}SO_{4}+H_{2}O + CO_{2}\uparrow$
$106$ $44$
$x$ $2.2g$
$\frac{106}{44}=\frac{x}{2.2g}$
$x = 5.3g$
废液中碳酸钠的溶质质量分数为$\frac{5.3g}{100g}×100\% = 5.3\%$
(4)偏大
【任务三】
(5)$Ca(OH)_{2}+Na_{2}CO_{3}=CaCO_{3}\downarrow + 2NaOH$
步骤1:取少量废液于试管中,加入足量的氯化钡稀溶液 产生白色沉淀 废液中有$Na_{2}CO_{3}$
步骤2:取少量步骤1中的上层清液于试管中,滴加酚酞试液 溶液变红 m 废液中有$NaOH$
【任务二】
(1)将生成的二氧化碳全部排入装置C、D中,使其完全被吸收。
(2)$2NaOH + CO_{2}=Na_{2}CO_{3}+H_{2}O$
(3)解:设废液中碳酸钠的质量为$x$。
装置C、D增加的质量为生成二氧化碳的质量,即$m(CO_{2}) = 2.1g + 0.1g = 2.2g$
$Na_{2}CO_{3}+H_{2}SO_{4}=Na_{2}SO_{4}+H_{2}O + CO_{2}\uparrow$
$106$ $44$
$x$ $2.2g$
$\frac{106}{44}=\frac{x}{2.2g}$
$x = 5.3g$
废液中碳酸钠的溶质质量分数为$\frac{5.3g}{100g}×100\% = 5.3\%$
(4)偏大
【任务三】
(5)$Ca(OH)_{2}+Na_{2}CO_{3}=CaCO_{3}\downarrow + 2NaOH$
查看更多完整答案,请扫码查看


